盖斯定律指出:化学反应的焓变只与各反应物的始态和各生成物的终态有关,而与具体的反应途径无关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是
| A.A→F,ΔH=-ΔH6 |
| B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1 |
| C.C→F,|ΔH|=|ΔH1+ΔH2+ΔH6| |
| D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6| |
下列有关实验原理或实验操作正确的是
| A.用蒸馏水湿润的pH试纸测量某溶液的pH=10 |
| B.用25mL的酸式滴定管量取14.80mL的NH4Cl溶液 |
| C.向铁钉上镀铜时,铁钉连接直流电源的正极 |
| D.用10 mL量筒量取0.5000 mol·L-1 H2SO4溶液5.50 mL |
常温下,pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=11,则强碱溶液和强酸溶液的体积之比为
| A.1∶9 | B.9∶1 | C.1∶11 | D.11∶1 |
某温度下,已知反应mX(g)+nY(g) 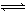 qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
| A.若将容器体积变为原来一半,c(Z)为原来的1.8倍,则m+n<q |
| B.该反应达到平衡时,加入Y,该反应的ΔH改变增大 |
| C.升高温度,c(Y)/c(Z)的值减小 |
| D.使用催化剂,就可反应完全 |
在容积一定的密闭容器中,进行可逆反应N2(g)+3H2(g)  2NH3(g) ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH3的体积分数),下列说法中不正确的是
2NH3(g) ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH3的体积分数),下列说法中不正确的是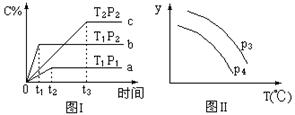
| A.T2<T1 |
| B.P2>P1 |
| C.若P3<P4,y轴表示N2的转化率 |
| D.若P3>P4,y轴表示NH3的体积分数 |
某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g)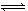 Z(g)+W(s) ΔH>0,下列叙述正确的是
Z(g)+W(s) ΔH>0,下列叙述正确的是
| A.在容器中加入氩气,反应速率不变 |
| B.加入少量W,逆反应速率增大 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.将容器的体积压缩,可增大单位体积内活化分子的百分数,有效碰撞次数增大 |