下列叙述正确的是(用NA代表阿伏加德罗常数的值)
| A.2.4 g金属镁变为镁离子时失去的电子数为0.1NA |
| B.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl— 个数为 NA |
| C.标准状况下22.4 L的CH4与18 g H2O所含的质子数均为10NA |
| D.常温常压下,10.6g Na2CO3含有的Na+离子数为2 NA |
实验室中要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜用的试剂是
| A.NaOH溶液 | B.Ba(OH)2溶液 | C.盐酸 | D.氨水 |
下列变化中,需要加入氧化剂才能实现的是:()
| A.MnO2 →MnSO4 | B.CuO→Cu | C.KI →KIO3 | D.HNO3→NO |
下列物质中,属于电解质的是
| A.HCl | B.NH3 | C.蔗糖 | D.浓硫酸 |
25℃,101kPa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3 kJ/mol;辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是()
A.CH3COOH(aq)+NaOH(aq)="==" CH3COONa(aq)+H2O(l) 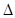 H= H= 57.3kJ/mol 57.3kJ/mol |
B.KOH(aq)+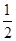 H H SO4(aq)= SO4(aq)= 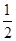 K2SO4(aq)+H2O(l) K2SO4(aq)+H2O(l)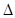 H= H=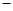 57.3kJ/mol 57.3kJ/mol |
C.C8H18(l)+ 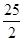 O2 (g)=8CO2 (g)+ 9H2O(g) O2 (g)=8CO2 (g)+ 9H2O(g) H= H=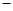 5518 kJ/mol 5518 kJ/mol |
D.2C8H18(g)+25O2 (g)=16CO2 (g)+18H2O(1)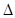 H= H=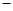 11036 kJ/mol 11036 kJ/mol |
已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1)△H1 = ―Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H2 = ―Q2 KJ/mol
2H2(g)+O2(g)==2H2O(1) △H3 = ―Q 3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是()
| A.放出的热量为(0.4Q1+0.05Q3)KJ/mol |
| B.放出的热量为(0.4Q1+0.05Q2)KJ/mol |
| C.△H2>△H3 |
| D.△H2<△H3 |