0.6mol·L-1Fe2(SO4)3和1.2mol·L-1CuSO4的混合溶液200mL,加入一定量铁粉充分反应后,测得溶液中Fe2+与Cu2+物质的量之比为2:1,则加入铁粉的物质的量为
| A.0.16mol | B.0.22mol | C.0.30mol | D.0.48mol |
人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种同位素应表示为
A.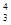 He He |
B.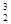 He He |
C.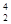 He He |
D.He |
明矾[KAl(SO4)2·12H2O]中S元素的化合价是
| A.-2 | B.+2 | C.+4 | D.+6 |
向淀粉溶液中分别加入下列物质,能使溶液变蓝的是
| A.氯水 | B.溴水 | C.碘化钾 | D.碘水 |
下列描述的物质一定是金属单质的是
| A.能失去电子的物质 | B.能得到电子的物质 |
| C.由含11个质子的原子构成的物质 | D.能与水反应的物质 |
铜、锌和硫酸构成的原电池中,当导线中有1 mol电子通过时,理论上两极的变化是()
①锌片溶解32.5 g ②锌片增重32.5 g ③铜片上析出1 g H2 ④铜片上析出1 mol H2
| A.①③ | B.①④ | C.②③ | D.②④ |