可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应
①Br2 + 2e- = 2Br— ②2Br— - 2e- = Br2 ③Zn – 2e- = Zn2+ ④Zn2+ + 2e- = Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是
| A.②和③ | B.②和① | C.③和① | D.④和① |
下列实验设计及其对应的离子方程式均正确的是
| A.钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B.用过氧化钠与水反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| C.用氨水检验氯化镁溶液中混有氯化铝杂质: Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| D.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
下列是某学生总结的一些规律,其中正确的是
| A.一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物 |
| B.酸性氧化物都可以与碱反应,生成盐和水 |
| C.酸根离子中不可能含有金属元素 |
| D.氧化物只能做氧化剂,不能做还原剂 |
下列能达到实验目的的是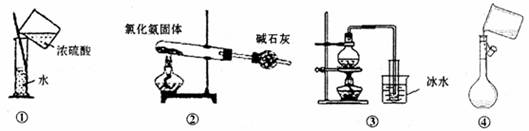
| A.用装置①稀释浓硫酸 | B.用装置②制备氨气 |
| C.用装置③从海水中制备少量蒸馏水 | D.用装置④向容量瓶中转移溶液 |
下列实验过程中,无明显现象的是
| A.NO2通入FeSO4溶液中 |
| B.胆矾中加入浓硫酸 |
| C.CO2通入CaCl2溶液中 |
| D.SO2通入已酸化的Ba(NO3)2溶液中 |
下列说法正确的是
| A.胶体粒子的直径很小可以透过滤纸,因此可以用过滤的方法分离胶体和溶液 |
| B.布朗运动不是胶体特有的性质 |
| C.直径介于l-100nm之间的微粒称为胶体 |
| D.有的胶体带正电荷或者负电荷,在电压作用下可电泳 |