下列与化学反应能量变化相关的叙述正确的是( )
| A.生成物总能量一定低于反应物总能量 |
| B.等量H2在O2中完全燃烧,生成H2O(g)与生成H2O(l)放出的能量相同 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同 |
下列各组 物质中,均为纯净物的一组是
物质中,均为纯净物的一组是
| A.碘酒干冰 | B.液氯浓硫酸 |
| C.石灰石氨水 | D.CuSO4·5H2O NaNO3 |
西维因是一种高效低毒杀虫剂,在碱性条件下可水解:
有关说法正确的是
| A.西维因分子式为C12H10NO2 |
| B.反应后经酸化,可用FeCL3溶液检验是否发生水解 |
| C.1mol西维因最多能与6mol氢气发生加成反应 |
| D.西维因分子中至少有21个原子共平面 |
用括号内试剂和方法除去下列各物质中的少量杂质,正确的是
| A.甲烷中的甲醛(水,洗气) |
| B.乙烷中的乙烯(酸性高锰酸钾溶液,洗气) |
| C.乙酸乙酯中的乙酸(NaOH溶液,分液) |
| D.苯中的苯酚(浓Br2水,过滤) |
下列反应的离子方程式正确的是
| A.苯酚与氢氧化钠溶液反应 C6H5OH+OH— →C6H5O—+H2O |
| B.碳酸钙溶于醋酸 CaCO3+2H+=Ca2++CO2↑+H2O |
| C.碳酸钠溶液加入过量的苯酚 2C6H5OH+CO32—→2C6H5O—+ CO2↑+H2O |
| D.甲醛溶液中加入足量的银氨溶液并加热: |
HCHO+2[Ag(NH3)2]++2OH-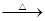 HCOO-+NH4++2Ag↓+3NH3+H2O
HCOO-+NH4++2Ag↓+3NH3+H2O
乙醇分子结构中各种化学键如图所示,关于乙醇在各反应中断裂键的说明不正确的是
| A.和金属钠反应是键①断裂 |
| B.和浓硫酸共热到170℃时断键②和⑤ |
| C.和浓硫酸共热到140℃时断键②,其它键不断 |
| D.和浓氢溴酸混合加热时断键② |