用标准的NaOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )
| A.配制标准溶液的固体NaOH中混有杂质KOH |
| B.滴定终点读数时,俯视滴定管的刻度,其他操作正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 |
| D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是
①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中
A.②③①④ B.③②①④ C.③①②④ D .①②③④
.①②③④
如图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为:2K2S2+KI3 K2S4+3KI。装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是( )
K2S4+3KI。装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是( )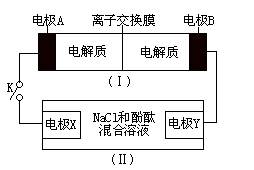
| A.K+从右到左通过离子交换膜 |
| B.电极A上发生的反应为:3I--2e-=I3- |
| C.电极X上发生的反应为:2Cl--2e-=C12↑ |
| D.当有0.1molK+通过离子交换膜,X电极上产生1.12L气体(标准状况) |
常温下,向10mL0.1mol·L-1NaOH溶液中逐滴加入0.1mol·L-1醋酸溶液,所得滴定曲线如图所示。下列说法正确的是( )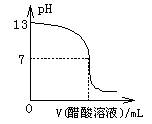
| A.pH=7时,所加醋酸溶液的体积为10mL |
| B.pH<7时,溶液中c(CH3COO-)>c(Na+) |
| C.7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.继续滴加0.1mol·L-1醋酸溶液,溶液pH可以变为1 |
下表中的实验操作能达至实验目的或得出相应结论的是 ( )
| 选项 |
实验操作 |
实验目的或结论 |
| A |
某实验得到热化学方程式: S(l)+O2(g)=SO2(g);ΔH=-293.23kJ/mol |
1molSO2的键能的总和小于1mol硫和1mol氧气的键能之和 |
| B |
C2H5Br与NaOH溶液混合充分振荡,再加入AgNO3溶液 |
检验C2H5Br中的溴元素 |
| C |
向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 |
说明溶液中一定含有Fe2+ |
| D |
将少量某物质滴加到新制的氢氧化铜悬浊液中,加热后有红色沉淀生成 |
说明该物质一定是醛 |
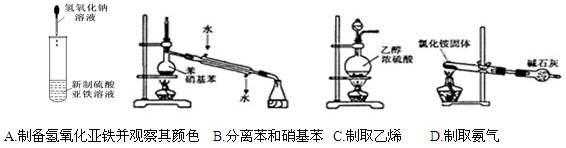
下列实验装置和操作正确的是( )