HA为酸性略强于醋酸的一元弱酸,在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是
| A.c(Na+)+ c(H+) = c(A-)+ c(OH-) | B.c(Na+)>c(OH-)>c(A-)>c(H+) |
| C.c(Na+)+ c(OH-)= c(A-)+ c(H+) | D.c(Na+)>c(A-)>c(H+)>c(OH-) |
用水稀释0.1mol· L-1的醋酸溶液,下列说法正确的是
| A.醋酸的电离程度逐渐增大,溶液的PH值减小 |
| B.Kw逐渐减小 |
| C.水的电离程度增大 |
D.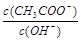 变大 变大 |
在一定温度下,向2L体积固定的密闭容器中加入1molHI,2HI H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确有是
H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确有是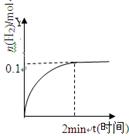
A.该温度下,反应的平衡常数是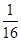 |
| B.0~2min内的HI的平均反应速率为0.05mol·L-1·min-1 |
| C.恒压下向该体系中加入N2,平衡不移动,反应速率不变 |
| D.升高温度,平衡向正反应方向移动,只有正反应速率加快 |
锂钒氧化物电池的能量密度远远超过其他材料电池,电池总反应式为:V2O5+xLi→LixV2O5,下列说法不正确的是
| A.向外供电时,锂离子向负极移动 |
| B.负极上反应的物质是锂,正极上反应的物质是V2O5 |
| C.正极的电极反应为:V2O5+xe-+xLi+→LixV2O5 |
| D.负极的电极反应为:xLi-xe-→ xLi+ |
反应SiO2(s)+3C(s)=SiC(s)+2CO(g)△H>0的叙述中,正确的是
| A.氧化剂是SiO2 |
| B.氧化剂与还原剂的物质的量之比为1∶2 |
| C.碳在反应中只做还原剂 |
| D.若生成1molSiC转移电子为2mol |
下列反应中生成物总能量高于反应物总能量的是
| A.碳酸钙受热分解 | B.钠与水反应 |
| C.铝粉与氧化铁粉末反应 | D.氧化钙溶于水 |