为了验证二氧化碳与氢氧化钠可以发生化学反应,某小组用下图所示装置进行实验。请回答下列问题: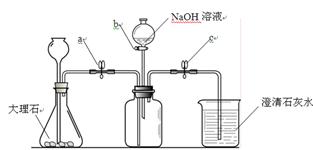
(1)打开止水夹a和c,从长颈漏斗向锥形瓶中注入稀盐酸至 时停止。
(2)当观察到烧杯中有大量白色沉淀产生时,说明集气瓶中已集满二氧化碳气体。然后进行的操作是 ,关闭活塞b,轻轻振荡集气瓶。一段时间后可观察到 ,证明二氧化碳与氢氧化钠发生了化学反应,该反应的化学方程式为 。
(3)小红认为仅做上述实验有不足之处,应利用上图装置做一个对比实验。该对比实验只需将所用的氢氧化钠溶液换成 即可。
(4)为了保证实验的成功,应在实验前对装置的气密性进行检验(不另加仪器),方法为 。
实验室有三瓶试剂,分别是稀盐酸、饱和石灰水和饱和纯碱溶液。康康用上述试剂做了三个实验(指示剂自选):①证明其中的酸和碱之间确实发生了化学反应;②二者混合会有气体产生;③二者混合会有沉淀产生。请写出:
(1)实验①中的操作过程。(2)实验②中的化学方程式。(3)实验③ 中的化学方程式。
同学们在学习碱的化学性质时,进行了如图所示的实验。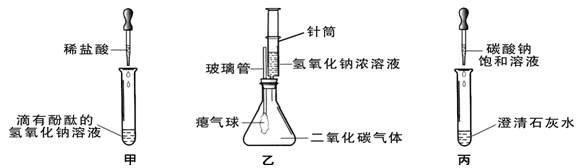
(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式。
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是。
(3)丙实验中观察到试管内有白色沉淀产生。
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问。
【提出问题】废液中含有哪些物质?
【交流讨论】①一定含有的物质:碳酸钙、指示剂、水和(写物质名称) 。
②还含有能使废液呈碱性的物质。能使废液呈碱性的物质是什么?同学们有如下猜想。
小云认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是。(写一种猜想)
【实验设计】小方想用氯化钙溶液来验证小云、小红、小林的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小方的实验设计补充完整。
| 实验内容 |
预计现象 |
预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置。 |
①有白色沉淀,溶液呈红色。 |
的猜想正确。 |
| ②。 |
的猜想正确。 |
|
| ③。 |
的猜想正确。 |
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑。
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。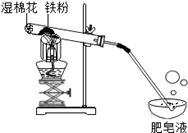
(1)试管尾部放一团湿棉花的目的是_______________。
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是_________。
(3)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 |
FeO |
Fe2O3 |
Fe3O4 |
| 颜色、状态 |
黑色粉末 |
红棕色粉末 |
黑色晶体 |
| 能否被磁铁吸引 |
否 |
否 |
能 |
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________。
【实验探究】
| 实验操作 |
实验现象及结论 |
【实验结论】铁和水蒸气反应的化学方程式为___________________________________。
【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________。
【 拓展 】 把赤铁矿冶炼成铁,其主要反应原理是在高温下,一氧化碳夺取铁矿石里的氧,将铁还原出来,请写出化学反应方程式:______________________________________。
在一次化学实验探究活动中,老师给某学习小组一瓶由碳酸钠溶液与澄清石灰水混合反应后,并经过滤得到的无色滤液,要求对该无色滤液中溶质的成分进行探究,请你一同参与他们的探究活动。
【提额出猜想】滤液中溶质的成分有如下几种可能:
| A.NaOH |
| B.Na2CO3、Ca(OH)2、NaOH |
| C.Na2CO3和NaOH |
| D. 【讨论交流】(1)上述猜想中,肯定不成立的一项是(填猜想序号),其理由是; (2)某同学取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明是不成立的(填猜想序号)。 (3)为了进一步确定溶液的成分,同学们设计实验方案,写出实验步骤以及预期现象与结论 实验步骤 预期现象及实验结论 |
固体混合物是由氧化钙、纯碱和食盐组成。某兴趣小组取少量固体在水中充分溶解,搅拌后过滤,探究其滤液成分。请回答有关问题:
(1)经分析滤液中一定有NaCl和NaOH,生成氢氧化钠的化学方程式为。
(2)某研究小组对滤液中其他成分做出了如下假设:
假设1:还可能含有CaCl2
假设2:还含有一种盐,它可能是(填化学式)
假设3:还含有一种碱,它可能是(填化学式)
(3)完成实验方案。请填写实验操作、与表中结论相符的预期现象。
限选试剂:稀HCl、NaOH溶液、Na2CO3溶液、AgNO3溶液、 BaCl2溶液
| 实验操作 |
预期现象 |
结论 |
| 假设2成立。 |
||
| 假设3成立。 |