ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 =2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
| A.KClO3在反应中得到电子 | B.ClO2是氧化产物 |
| C.H2C2O4在反应中被还原 | D.1mol KClO3参加反应有2 mol电子转移 |
在盛放酒精的试剂瓶上应印有如下图所示警示标记中的
在等物质的量浓度的两种弱酸的钠盐(NaR、NaR′)溶液中分别通入适量的CO2,发生如下反应:NaR+CO2+H2O=HR+NaHCO3,2NaR′+CO2+H2O="2HR′+" Na2CO3。现有物质的量浓度相同的四种溶液:①HR②HR′③NaR④NaR′,由水电离出c(OH-)大小顺序是
| A.①>②>③>④ | B.②>①>④>③ |
| C.③>④>①>② | D.④>③>②>① |
下列说法正确的是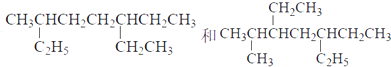
| A.主链碳原子数均为7个 |
| B.主链含5个碳原子,有甲基、乙基2个支链的烷烃有三种 |
| C.新戊烷、正丁烷、异丁烷和丙烷的熔沸点依次降低 |
| D.C7H16的烷烃中,含有3个甲基的同分异构体有2种 |
25℃ 时,水的离子积为Kw,该温度下将 a mol ·L-盐酸 与b mol·L-1氨水等体积混合,若恰好完全反应,下列结论中不正确的是
A.混合液中:c(H+ ) ≤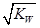 |
| B.混合液中:c(NH3·H2O)+c(NH4+)=0.5a mol·L-1 |
| C.a = b |
| D.混合液中:c(H+)+c(NH4+)= c(OH-)+c(Cl-) |
下列说法错误的是
| A.常温下,若醋酸钠与醋酸的混合溶液pH=7,则C(Na+)=c(CH3COO-) |
| B.某温度下,pH=6的NaCl溶液中离子浓度的大小关系:c(Na+)= c(Cl-)>c(H+)>c(OH-) |
| C.若2a mol·L-1HCN与a mol·L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则混合溶液pH>7 |
| D.含0.1 mol NaHCO3和0.2molNa2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—) |