乙酸苯甲酯可提高花或果的芳香气味,常用于化妆品工业和食品工业。下图是乙酸苯甲酯的一种合成路线(部分反应物、产物和反应条件略去)。

请回答:
(1)运用逆合成分析法推断,C的结构简式为 。
(2) 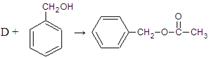 的化学方程式为
的化学方程式为
。
(3)与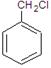 互为同分异构体的芳香族化合物有 种,其中一种同分异构体的核磁共振氢谱有三种类型氢原子的吸收峰,该同分异构体的结构简式为 。
互为同分异构体的芳香族化合物有 种,其中一种同分异构体的核磁共振氢谱有三种类型氢原子的吸收峰,该同分异构体的结构简式为 。
火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S===K2S+N2↑+3CO2↑。
(1)其中被还原的元素是
(2)当反应有3.612×1024个电子转移时被硝酸钾氧化得到的氧化产物在标准状况下的体积。
(10)按要求填空
(1)金属钠与水反应的化学方程式:
(2)金属铝与氢氧化钾反应的离子方程式:
(3)硫酸氢钠与少量的氢氧化钡反应的离子方程式:
(4)Na+的原子结构示意图:
(5)标准状况下11.2L N2含有的原子数:
(6)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则A的摩尔质量是___
【化学——选修5:有机化学基础】
A、B、C、D、E、F都是链状有机物,它们的转化关系如图所示。A中只含有一种官能团,D中含有两种官能团,D分子中不含甲基,且与碳原子相连的氢原子取代所得的一氯代物只有一种。请回答下列问题: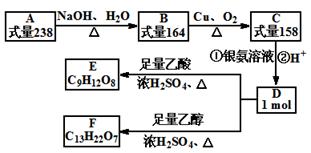
(1)A中含有的官能团是。
(2)请写出B生成C的化学方程式。
(3)写出C与银氨溶液反应的化学方程式。
(4)请考虑满足下列条件的E的同分异构体有种
①遇FeCl3溶液显紫色;②含有3个-CH2OH结构;③不含有“-O-O-”这样不稳定的结构
【化学—选修3物质结构与性质】(14分)
现有X、Y、Z、W原子序数依次增大的四种元素,常温下X元素单质的密度在自然界中最小,Y是短周期元素中未成对电子数与原子序数之比最大的原子,Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等,且Y与Z可形成多种气态化合物,W是常见的有色可变价金属单质,常温下可溶于Y的最高价氧化物水化物中,其基态原子的内层轨道全部排满电子,且最外层电子数为1。
(1)Y与W所形成化合物晶体的晶胞如图所示。在1个晶胞中,W离子的数目为。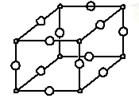
(2)在Y与X形成的分子中,Y原子轨道的杂化类型是。
(3)X与Y形成的气态物质在X与Z形成的气态物质中有很大的溶解度,其原因是存在氢键,若在两种氢化物的混合溶液中,再滴加少量的乙醇,则分子间存在种不同类型的氢键。
(4)Y与Z可形成化合物Y2Z。
①请写出一种与Y2Z互为等电子体的分子的化学式。
②请预测Y2Z分子的空间构型为。
(5)Y与Z元素相比,基态原子的第一电离能谁大?(用元素名称回答)。
(6)X的氯化物与Y元素的气态氢化物的水溶液反应可形成配合物[W(YX3)4]Cl2,1 mol该配合物中含有σ键的数目为个。
电解原理在工业生产中有广泛的应用。
(1)如图为离子交换膜法电解饱和食盐水的原理示意图,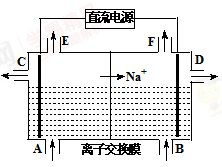
下列说法不正确的是。
| A.直流电源的左侧为负极 |
| B.从E口逸出的气体是H2 |
| C.从B口加入含少量NaOH的水溶液以增强导电性 |
| D.从C口出来的溶液为NaOH溶液 |
E.每生成22.4 L Cl2,便产生2 mol NaOH
F.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3溶液
G.该离子交换膜为阳离子交换膜
(2)双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为:3H2O+3O2  O3+3H2O2。则阳极的电极反应式为,阴极的电极反应式为。
O3+3H2O2。则阳极的电极反应式为,阴极的电极反应式为。
(3)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂。工业上用如下方法制备高铁酸钾:以Fe2O3为阳极电解KOH溶液。
①高铁酸钾溶液长时间放置不稳定,会产生红色絮状物质及气泡,则该过程的离子方程式为。
②电解制高铁酸钾时阳极的电极反应式为。