下列溶液中Cl-的物质的量浓度最大的是
| A.200mL 2.5mol/L MgCl2溶液 | B.1000mL 4mol/L NaCl溶液 |
| C.400mL 5mol/L KClO3溶液 | D.250mL 2mol/L AlCl3溶液 |
有关如图装置的叙述不正确的是( )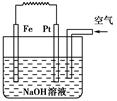
| A.这是电解NaOH溶液的装置 |
| B.该装置中Pt为正极,电极反应为O2+2H2O+4e-―→4OH- |
| C.该装置中Fe为负极,电极反应为Fe+2OH-―→Fe(OH)2+2e- |
| D.这是一个原电池装置 |
下面有关电化学的图示,完全正确的是( )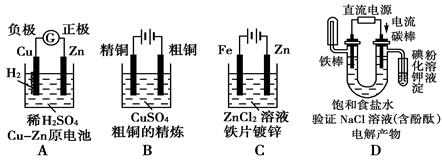
有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易被腐蚀;将A、D分别投入到等浓度的盐酸中,D比A反应剧烈;将铜浸入B的盐溶液中无明显变化;将铜浸入C的盐溶液中,有金属C析出。据此可推知它们的金属活动性由强到弱的顺序为 ()
A.D>C>A>BB.D>A>B>C C.D>B>A>C D.B>A>D>C
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)==2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
(3)H2(g)+O2(g)===H2O(l)ΔH3=-285.8 kJ·mol-1,
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变ΔH为( )
| A.488.3 kJ·mol-1 | B.-244.15 kJ·mol-1 |
| C.244.15 kJ·mol-1 | D.-488.3 kJ·mol-1 |
一定量的混合气体,在密闭容器中发生如下反应:xA(g) + yB(g)  zC(g),达到平衡后测得A气体的浓度为1mol·L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.7mol·L-1,则下列叙述正确的是〔〕
zC(g),达到平衡后测得A气体的浓度为1mol·L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.7mol·L-1,则下列叙述正确的是〔〕
| A.平衡向正反应方向移动 | B.x + y = z |
C.C的体积分数升高 |
D.B的转化率降低 |