为了除去镁粉中的少量铝粉,可以选取下列哪种溶液 ( )
| A.浓盐酸 | B.浓硝酸 | C.浓硫酸 | D.浓氢氧化钠溶液 |
在下图所示的原电池中,下列说法正确的是()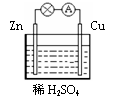
| A.Zn为负极,Cu为正极 |
| B.正极反应为 Zn - 2e-=Zn2+ |
| C.负极反应为Cu - 2e- = Cu2+ |
| D.该装置能将电能转化为化学能 |
右图曲线a表示放热反应 X(g) + Y(g)  Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是()
Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是()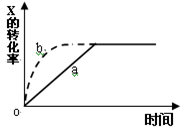
| A.升高温度 | B.加大X的投入量 | C.加催化剂 | D.增大体积 |
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为()
| A.a > b > c > d | B.a > c > d > b |
| C.c > a > b .> d | D.b > d > c > a |
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是()
A. |
B. |
| C.c(H+)和c(OH-)的乘积 | D.OH-的物质的量 |
常温下1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于()
| A.9.0 | B.9.5 | C.10.5 | D.11.5 |