下列反应的离子方程式正确的是
|
A.氢氧化铁溶于氢碘酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
B.用惰性电极电解饱和食盐水:2Cl一 + 2H2O 2 OH一 + H2↑+ Cl2↑下列说法中,正确的是:
①在水中氢、氧原子间均以化学键相结合。
②金属和非金属化合一定形成离子键。
③离子键的实质是阳离子、阴离子间的相互吸引。
④根据电离方程式HCl = H+ + Cl-,判断HCl分子里存在离子键。
⑤某些共价化合物中含有离子键
| A.①②⑤正确 | B.都不正确 | C.③④正确 | D.仅⑤正确 |
关于下列图示的说法中正确的是:
| A.图①表示从碘水中分离出碘的操作方法 |
| B.图②为电解氯化钠溶液的装置,一段时间后两极收集到气体的体积之比一定为1:1 |
| C.图③为测定溶液pH的实验操作 |
| D.图④可以用来制备氢氧化亚铁沉淀 |
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如下图。
反应中镁和铝的: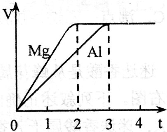
| A.物质的量之比为3:2 |
| B.质量之比为3:2 |
| C.摩尔质量之比为2:3 |
| D.反应速率之比为2:3 |
硫—碘循环分解水制氢主要涉及下列反应: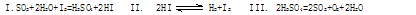
分析上述反应,下列判断正确的是:
| A.循环过程中需补充H2O | B.反应I中SO2氧化性比HI强 |
| C.反应III易在常温下进行 | D.循环过程中产生1molO2的同时产生1 molH2 |
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价):
| A.NaBH4既是氧化剂又是还原剂 | B.被氧化的元素与被还原的元素质量比为1:1 |
| C.硼元素被氧化,氢元素被还原 | D.NaBH4是氧化剂,H2O是还原剂 |