常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200 mL C(OH-)= 0.1mol/L的溶液,然后逐滴加入1 mol/L 的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是 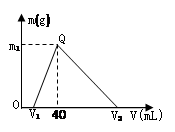
| A.原合金质量为 0.92 g |
| B.图中V2为 60 |
| C.整个加入盐酸过程中 Na+的浓度保持不变 |
| D.Q点m1为1.56 |
反应4 (气)+5
(气)+5 (气)="=" 4NO(气)+6
(气)="=" 4NO(气)+6 (气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率 (X)(反应物的消耗速率或产物的生成速率)可表示为 ( )
(X)(反应物的消耗速率或产物的生成速率)可表示为 ( )
A. (NH3)=0.0100mol.L-1.s-1 (NH3)=0.0100mol.L-1.s-1 |
B. (O2)=0.0010mol.L-1.s-1 (O2)=0.0010mol.L-1.s-1 |
C. (NO)=0.0010mol.L-1.s-1 (NO)=0.0010mol.L-1.s-1 |
D. (H2O)=0.045mol.L-1.s-1 (H2O)=0.045mol.L-1.s-1 |
某Li+原子核中含有4个中子。含6.02×1023个电子的该离子质量是( )
| A.4/7 g | B.4.7g | C.3.5g | D.7/4g |
盐酸倒在碳酸钠粉末上,能使反应的最初速率加快的是( )
A.增加碳酸钠的用量 B.盐酸浓度不变,使用量增加一倍
B.盐酸浓度增加一倍,使用量减半D.盐酸浓度不变,使用量减半
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是
| X |
Y |
||||
| Z |
W |
Q |
A.元素W的最高价氧化物对应的水化物的酸性比Q的强
B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C.离子半径的大小顺序为rZ 3+>rY2-
D.元素X与元素Z的最高正化合价之和的数值等于8
下列关于化学观或化学研究方法的叙述,错误的是 ( )
| A.根据元素周期律,由HClO4可类推出氟元素也存在最高价氧化物的水化物HFO4 |
| B.在元素周期表的金属和非金属分界线附近寻找半导体材料 |
| C.控制实验条件可以改变可逆反应的限度和速率 |
| D.Na、K在周期表中属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应 |