某粗盐中含有Ca2+、Mg2+、SO42-等杂质,现测定氯化钠含量。取120g粗盐溶于水过滤除去6g不溶物,向滤液中依次加入过量的下列试剂:1mol/L的氢氧化钠溶液200 mL、4.56g固体氯化钡、31.8%的碳酸钠溶液10g,发现白色沉淀逐渐增多,过滤除去沉淀物,再往滤液中加入过量的盐酸,使溶液呈酸性,加热蒸发得氯化钠晶体126.65g,则粗盐中含氯化钠的质量分数为
| A.94.1% | B.92.9% | C.86.3% | D.83.2% |
下列实验的现象与对应结论均正确的是
| 选项 |
操作 |
现象 |
结论 |
| A |
将浓硫酸滴到蔗糖表面 |
固体变黑膨胀 |
浓硫酸有脱水性和强氧化性 |
| B |
常温下将Al片放入浓硝酸中 |
无明显变化 |
Al与浓硝酸不反应 |
| C |
二氧化硫通入品红溶液中 |
品红溶液褪色 |
二氧化硫具有还原性 |
| D |
将水蒸气通过灼热的铁粉 |
粉末变红 |
铁与水在高温下发生反应 |
Al、Fe、Cu都是重要的金属元素,下列说法正确的是
| A.三者对应的氧化物均为碱性氧化物 |
| B.三者的单质放置在空气中均只生成氧化物 |
| C.制备AlCl3、FeCl3、CuCl2固体均不能采用将溶液直接蒸干的方法 |
| D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
工业上生产下列物质,不涉及氧化还原反应的是
| A.用铝矾土(主要成分Al2O3)生产金属铝 |
| B.用硫铁矿(主要成分FeS2)生产硫酸 |
| C.用海水、贝壳生产氯化镁晶体 |
| D.用氯化钠生产烧碱 |
下列相关实验的装置示意图正确的是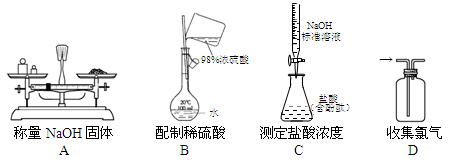
中学常见物质A、B、C、D、E、X,存在转化关系 (部分生成物和反应条件略去):  。下列推断不正确的是
。下列推断不正确的是
A.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B.若D是一种强碱,则A、B、C均可与X反应生成D
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C