根据下列实验方法和现象,得出结论正确的是( )
A.某溶液 生成白色沉淀,则原溶液中一定含有Cl— 生成白色沉淀,则原溶液中一定含有Cl— |
B.某溶液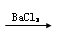 生成白色沉淀,则原溶液中一定含有SO42— 生成白色沉淀,则原溶液中一定含有SO42— |
C.某溶液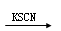 溶液呈红色,则原溶液中一定含有Fe3+ 溶液呈红色,则原溶液中一定含有Fe3+ |
D.某溶液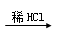 有气体产生,则原溶液中一定含有CO32— 有气体产生,则原溶液中一定含有CO32— |
下列各组给定原子序数的元素,能形成原子数之比为1∶1稳定化合物的是()
① 1和6② 7和8③ 8 和 12④ 12和17⑤ 20和35
| A.①②④ | B.②③⑤ | C.①②③ | D.③④⑤ |
下列相关反应的离子方程式书写正确的是()
| A.氢氧化铁溶于氢碘酸:Fe(OH)3 +3H+ =Fe3++3H2O |
| B.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3—+Ba2++2OH— = BaCO3â +2H2O+CO32— |
| C.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D.向含有0.4 mol FeBr2的溶液中通入0.1 mol Cl2反应:2Fe2++Cl2=2Fe3+ +2Cl- |
欲验证某瓶中装的是氨水,现用一沾有浓盐酸的玻璃棒靠近瓶口,为了使现象明显,可先往瓶中加入一种物质,该物质可以选用下列物质中的()
①浓H2SO4②固体烧碱③固体碳酸钙④生石灰⑤固体NH4Cl⑥固体食盐
| A.①② | B.②④⑤ | C.②③④⑤ | D.①③⑥ |
下列有关物质的性质或结构的说法正确的是( )
| A.L层上的电子数为奇数的原子一定是主族元素的原子 |
| B.周期表中的碱金属元素从上到下,其单质的还原性逐渐增强,熔沸点逐渐升高 |
| C.化学键的形成一定伴随着电子的转移和能量变化 |
| D.元素周期表中,位于金属和非金属分界线附近的元素属于过渡元素 |
在下列指定条件的溶液中,能大量共存的一组离子是()
| A.pH=1的溶液中:NH4+、Fe2+、SO42-、ClO- |
| B.通入过量SO2气体后的溶液中:K+、Na+、CO32-、SO42- |
| C.AlO2一 的浓度为0.1 mol/L的溶液中:K+、Na+、SiO32-、SO42- |
| D.常温下,由水电离出的c(H+)=1×10-11 mol/L的溶液中:Fe3+、Br—、Cl-、SCN- |