根据下列反应判断有关物质还原性由强到弱的顺序是( )
H2SO3+I2+H2O=H2SO4+2HI
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
| A.I- > Fe2+ > H2SO3 > NO | B.H2SO3 > I- > Fe2+ > NO |
| C.Fe2+ > I-> H2SO3 > NO | D.NO >Fe2+ > H2SO3 > I- |
历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的是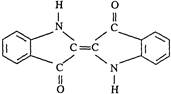
| A.靛蓝由碳、氢、氧、氮四种元素组成 |
| B.它的分子式是C16H10N2O2 |
| C.该物质是高分子化合物 |
| D.它是不饱和的有机物 |
下列所指物质不属于纯净物的是()
| A.分子式为C2H4Cl2的物质 |
| B.只含铁和氧两种元素且Fe的质量分数为72.41%的物质 |
| C.干冰 |
| D.按体积比为1:1混合NH3和HCl(同条件) |
下列说法正确的是( )
| A.20mL1 mol/L Al2(SO4)3溶液中,Al3+ 和SO42-离子总数为6.02×1023 |
| B.标准状况下,22.4L Cl2和HCl的混合气体中含分子总数为2×6.02×1023 |
| C.0.1 mol8135Br原子中含中子数为3.5×6.02×1023 |
| D.30g甲醛中含共用电子对总数为4×6.02×1023 |
物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是()
| A.①②③⑤ | B.①②⑤ | C.②⑤⑥ | D.①④⑤⑥ |
下列说法正确的是( )
| A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” |
| B.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 |
| C.废弃的塑料,金属、纸制品及玻璃都是可回收再利用的资源 |
| D.凡含有食品添加剂的食物对人体健康均有害,不宜食用 |