在Mg+4HNO3(浓)=Mg(NO3)2+2NO2↑+2H2O反应中,若有2mol的Mg被氧化,则被还原的硝酸的物质的量是:( )
| A.8mol | B.6mol | C.4mol | D.2mol |
用蒸汽密度法测定物质的相对分子质量是一种常用的方法。现测得0.2g某挥发性液体化合物样品在挥发时排出的空气在标准状况下是40mL,则该化合物的相对分子质量是

 ()
()
| A.80 | B.112 | C.168 | D.340 |
关于容量瓶的四种叙述:①是配制准确浓度的仪器;②不宜贮藏溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是()
| A.①②③④ | B.②③ | C.①②④ | D.②③④ |
如果a g 某气体中含有分子数为b,则c g该气体在标准状况下的体积是()


A.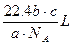 |
B. |
C.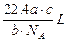 |
D.  |
下列有关气体体积的叙述中,正确的是()
A.在一定的温度和压强下,各种气态物质体积大小由构成气体分子大小决定 |
B.在一定的温度和压强下,各种气态物质体积的大小由构成气体的分子数决定 |
C.不同的气体,若体积不同,则它们所含的分子数一定不同 |
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4L |
下列有关叙述正确的是
①碱金属单质的密度通常情况下均比水小
②碱金属元素均具有强还原性
③碱金属的氢氧化物在加热的条件下均不分解
④热稳定性:Na2CO3>NaHCO3>H2CO3
⑤CsOH是离子化合物,易溶于水,且碱性比NaOH强
⑥Cs2CO3加热易分解成Cs2O和CO2
⑦Na、K、Rb、Cs中,Cs的熔点最高,密度最大
| A.全部 | B.全不正确 | C.④⑤ | D.①②④⑤⑦ |