下列对金、银、铜的描述错误的是( )
| A.金在电子工业中的用量占金在工业用量的90%以上 |
| B.金在自然界中主要以游离态存在,可用物理方法提取 |
| C.银在有机合成.能源开发.材料制造等方面有广泛的应用前景 |
| D.因为铜的导电.导热性不如金和银,故制造电线.电缆的材料绝大部分换成了金或银 |
(届辽宁省东北三省高三第二次模拟考试理综化学试卷)
相对分子质量为100的有机物A能与钠反应,且完全燃烧只生成CO2和H2O。若A含一个六碳环,则环上一氯代物的数目为
| A.5 | B.4 | C.3 | D.2 |
下列化合物的分子中,所有原子都处于同一平面的有
| A.乙烷 | B.甲苯 | C.氟苯 | D.四氯乙烯 |
下列反应中,属于取代反应的是
①CH3CH=CH2+Br2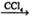 CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH 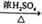 CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH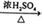 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3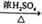 C6H5NO2+H2O
C6H5NO2+H2O
| A.①② | B.③④ | C.①③ | D.②④ |
分子式为C5H11Cl的同分异构体共有(不考虑立体异构)
| A.6种 | B.7种 | C.8种 | D.9种 |
NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下: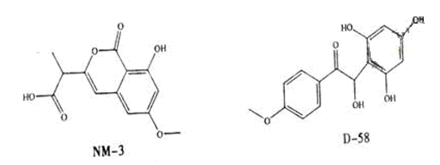
关于NM-3和D-58的叙述,错误的是
| A.都能与NaOH溶液反应,原因不完全相同 |
| B.都能与溴水反应,原因不完全相同 |
| C.都不能发生消去反应,原因相同 |
| D.遇FeCl3溶液都显色,原因相同 |