设NA表示阿伏加德罗常数,下列叙述中正确的是
| A.常温常压下,11.2L氧气所含的原子数为NA |
| B.1.8g的NH4+离子中含有的电子数为10NA |
| C.常温常压下,48gO3含有的氧原子数为3NA |
| D.2.4g金属镁变为镁离子时失去的电子数为0.1NA |
下列离子方程式书写正确的是( )
A.实验室用Fe和稀硫酸制氢气: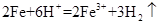 |
B.用浓盐酸与Mn02反应制取少量氯气: |
C.向碳酸氢钠溶液中加入氢氧化钠: |
D.用氢氧化钠溶液除去铝表面的氧化膜: |
下列说法正确的是( )
| A.需要加热才能发生的反应一定是吸热反应 |
| B.任何放热反应在常温条件下一定能发生反应 |
| C.反应物和生成物所具有的总能量决定了放热还是吸热 |
| D.C(石墨,s)=C(金刚石,s)△H>0,所以金刚石比石墨稳定 |
下列各组离子在指定溶液中,一定能大量共存的是( )
| A.无色溶液中:K+、H+、NO3-、[A1(0H)4]- |
| B.能与铝片反应产生氧气的溶液中:Al3+、Cl-、Fe2+、NO3- |
| C.在由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Ba2+、Cl-、Br- |
| D.含有较多Fe3+的溶液中:Na+、S042-、SCN-、I- |
下列事实不能证明HN02是弱电解质的是( )
①滴入酚酞,NaN02溶液显红色
②用HN02溶液做导电实验,灯泡很暗
③等pH、等体积的盐酸和HN02溶液中和碱时,HNO2的中和碱能力强
④0.1 mol·L-1HN02溶液的PH=2
⑤HN02与CaCO3反应放出CO2气体
⑥C(H+)="0.1" mol·L-1的HN02溶液稀释至1000倍,PH<4
| A.①⑤ | B.②⑤ | C.③⑥ | D.③④ |
用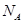 表示阿佛加德罗常数,下列说法正确的是( )
表示阿佛加德罗常数,下列说法正确的是( )
A.标准状态下22.4LS03分子数为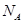 |
B.7.8gNa202含有的阴离子数是0.2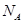 |
C.常温常压下,l6g02和16g03中所含原子数均为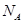 |
D.1L2mol·L-1的Al(NO3)3溶液中含Al3+个数为2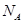 |