正确书写离子方程式时,下列各项中,应使等式两边相等的是( )
①离子数目相等 ②粒子总数相等 ③原子数目相等 ④阳离子所带正电荷总数跟阴离子所带负电荷总数相等 ⑤分子数目相等 ⑥各元素原子数目相等
| A.只有①⑤ | B.只有②④ | C.只有③⑥ | D.只有④⑥ |
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由下图表示,在下列因素中,影响反应速率的是()
①盐酸的浓度②镁条的表面积③溶液的温度④Cl-的浓度
| A.①④ | B.③④ | C.①②③ | D.②③ |
下列措施肯定能使化学反应速率增大的是()
①增大反应物的量②增大压强③升高温度④使用正催化剂
| A.①②③ | B.②③④ | C.③④ | D.①②③④ |
决定化学反应速率的主要因素是()
| A.使用催化剂 | B.反应物的性质 | C.温度和压强 | D.反应物的浓度 |
进行如下实验,在A锥形瓶中放入10 g块状CaCO3,在B锥形瓶中放入5 g粉末状的CaCO3,分别加入50 mL 2 mol·L-1盐酸。图中能正确表示实验结果的是()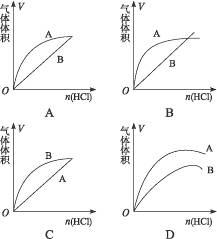
对于反应M+N→P,如果温度每升高10 ℃,反应速率增加为原来的3倍。在10 ℃,时完成该反应的10%需54 min;若将温度提高到40 ℃,完成反应的10%需要的时间为()
| A.2 min | B.3 min | C.6 min | D.9 min |