实验室里需用480 mL 0.1 mol/L的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作正确的是( )
| A.称取7.68g硫酸铜,加入500mL水 |
| B.称取12.0g胆矾配成500mL溶液 |
| C.称取8.0g硫酸铜,加入500mL水 |
| D.称取12.5g胆矾配成500mL溶液 |
依据右图分析,下列叙述不正确的是
| A.氯化钠是由钠离子和氯离子构成的 |
| B.氯化钠的电离方程式为:NaCl =Na+ + Cl— |
| C.氯化钠的电离过程需要通电才能完成 |
| D.氯化钠在水中形成能自由移动的水合钠离子和水合氯离子 |
核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪种原子不能产生NMR现象
A. P P |
B.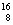 O O |
C. N N |
D. C C |
现在,人们已经知道,原子是由原子核与核外电子构成的。不过,人类对原子结构的认识是逐渐深入的,下列哪位是最先发现电子的科学家
| A.玻尔 | B.卢瑟福 | C.汤姆生 | D.道尔顿 |
胶体区别于其他分散系最本质的特征是
| A.外观澄清透明 | B.胶体有丁达尔效应 |
| C.不稳定 | D.分散质粒子直径在10-9--10-7m之间 |
分类法是一种行之有效、简单易行的科学方法。下列关于“Na2CO3”的分类错误的是
| A.Na2CO3俗名为纯碱,故它属于碱类 | B.Na2CO3属于化合物 |
| C.Na2CO3属于强电解质 | D.Na2CO3属于含氧酸盐 |