右图所示装置I是一种可充电电池,装置II为电解池。离子交换膜只允许Na 通过,充放电的化学方程式为2Na2S2+NaBr3
通过,充放电的化学方程式为2Na2S2+NaBr3  Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是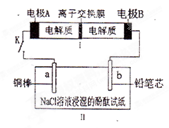
A.负极反应为4Na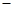 4e 4e =4Na =4Na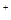 |
B.当有0.01 mol Na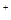 通过离子交换膜时, 通过离子交换膜时,b电极上析出标准状况下的气体112 mL |
| C.闭合K后,b电极附近的pH变小 |
| D.闭合K后,a电极上有气体产生 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
| A.25℃时,PH=13的1.0L Ba(OH)2溶液中含有的OH-离子数目为0.2NA |
| B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| D.标准状况下,22.4L SO3中含有的氧原子数为3.0NA |
下列实验操作或原理不正确的是( )
| A.除去氯化钠晶体中少量的硝酸钾 |
| B.纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 |
| C.只用淀粉溶液即可检验加碘食盐中是否含碘酸盐,从碘水中提取单质碘时,不能用无水乙醇代替CCl4 |
| D.可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油 |
下列除杂质的方法不可行的是( )
| A.用过量氨水除去Al3+溶液中的少量Cu2+ |
| B.将混合气体通过灼热的铜网除去N2中的少量O2 |
| C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 |
| D.用盐酸除去AgCl中少量的Ag2CO3 |
下列说法正确的是( )
| A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 |
| D.SO2和HClO都具有漂白作用,且漂白的化学原理相同 |
当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色溶液中通入SO2气体,又生成了白色沉淀:将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的是( )
| A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子 |
| B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应 |
| C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下,Cu+只被氧化 |
| D.反应过程中消耗的SO2与生成的SO2的物质的量相等 |