下面的叙述不正确的是( )
| A.原子的电子层数一定等于该元素在周期表里的周期数 |
| B.第2,3周期元素若形成XYn型共价化合物时各原子均达8电子稳定结构 |
| C.原子的电子层数不一定等于该元素在周期表里的周期数 |
| D.第2,3周期元素形成的XYn型共价化合物时有的原子最外层电子数可能多于8个 |
具有一个羟基的有机物A与8g乙酸充分反应生成了10.2g酯,经分析还有2g乙酸剩余,下列有可能是A的为
| A.C2H5OH | B.C6H5-CH2-OH | C. |
D.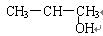 |
对下列有机反应类型的认识中,错误的是
A. ;取代反应 ;取代反应 |
| B.CH2=CH2 + Br2→CH2Br CH2Br;加成反应 |
| C.CH3CH2OH + HCl→CH3CH2Cl+ H2O;酯化反应 |
| D.2CH3CHO + O2→2CH3COOH;氧化反应 |
下列有关有机化合物的性质和用途的说法正确的是
| A.乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应 |
| B.乙烯、聚氯乙烯结构中都含有碳碳双键 |
| C.乙醇既可以作燃料,也可以在日常生活中使用,如无水乙醇可用于杀菌、消毒 |
| D.一溴甲烷与1,2—二溴乙烷互为同分异构体 |
有A、B、C、D四种金属,将A和B用导线连接起来,浸入电解质溶液中,B上有电子流入,将A、D分别投入等浓度的盐酸中,D比A反应剧烈,将铜浸入B的盐溶液中,无明显变化,如果把铜浸入C的盐溶液中,有金属C析出,据此判断A、B、C、D四种金属的活泼性由强到弱的顺序是
A.D>C>A>B B.D>A>B>C C.D>B>A>C D.B>A>D>C
可作为可逆反应 N2(g)+O2(g)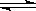 2 NO(g)已达到平衡状态的标志的是
2 NO(g)已达到平衡状态的标志的是
| A.单位时间内每生成 n mol N2,同时生成2 n mol NO |
| B.容器内反应混合物的总压强不随时间改变 |
| C.O2的消耗速率等于NO的消耗速率 |
| D.容器内始终有N2、、O2和NO共存 |