Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是:
| A.[Na+]>[S2-]>[OH-]>[HS-]>[H+] |
| B.[Na+]+[H+]==[S2-]+[HS-]+[OH-] |
| C.[Na+]==[HS-]+2[H2S]+2[S2-] |
| D.[OH-]==[H+]+[HS-]+[H2S] |
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是
| A.与W相邻的同主族元素可制成重要的半导体材料 |
| B.元素原子半径从大到小的顺序是X、Y、Z |
| C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构 |
| D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
W、X、Y、Z是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Y元素形成的单质,常温下丙和己均为气体。已知反应:甲+乙 丁+己,甲+丙
丁+己,甲+丙 戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是
戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是
| A.元素X在周期表中的位置为第2周期ⅥA族 |
| B.元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(X) |
| C.1 mol甲与足量的乙完全反应转移的电子数为6.02×1023 |
| D.1.0 L0.1 mol·L-1戊溶液中阴离子的总物质的量小于0.1 mol |
下列有关说法正确的是
| A.0.1mol/LNa2CO3溶液35℃时的碱性比25℃时强,说明盐类水解反应是放热反应 |
| B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br 、I的非金属性递增的规律 |
C.2SO2(g)+O2(g) 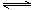 2SO3(g) △H<0,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大 2SO3(g) △H<0,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大 |
| D.室温下,同浓度的Na2CO3溶液的pH比 Na2SiO3溶液的pH小,说明非金属性C>Si |
下列叙述正确的是
① 7Li+中含有的中子数与电子数之比为2︰1
② 在C2H6分子中极性共价键与非极性共价键数之比为3︰1
③ 常温下,11.2 L的甲烷气体中含有的氢、碳原子数之比为4︰1
④ 5.6 g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2︰1
| A.① ② | B.② ③ | C.① ③ | D.③ ④ |
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中Z的核电荷数是Y的2倍。下列判断不正确的是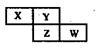
| A.最简单气态氢化物的热稳定性:Y>Z |
| B.最高价氧化物的水化物的酸性:X<W |
| C.X元素的氢化物与其最高价氧化物的水化物能形成离子化合物 |
| D.Y的氢化物沸点远高于Z的氢化物,是因为H-Y键的键能高于H-Z键的键能 |