A元素的最高价离子0.5mol被还原成中性原子时,要得到6.02×1023个电子,它的单质同盐酸充分反应时,放出0.02gH2,用去0.4gA。B元素的原子核外电子层数与A相同,且B元素形成的单质是红棕色液体。
(1)写出两种元素的名称:A. B. 。
(2)用结构示意图表示A、B两元素常见离子:
A. ,B. 。
(3) A、B形成的化合物中化学键的类型是 。
为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10 mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为。
(2)步骤①所需要的玻璃仪器有烧杯、玻璃棒、、。
(3) 完成并配平下列离子方程式:
C2O42++MnO4—+H+ = CO2+Mn2++
(4)步骤③中判断滴定终点的方法是。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数。(填“偏大”、“偏小”或“无影响”)
(6)试样中H2C2O4·2H2O的质量分数为。
(共12分)甲醇合成反应及其能量变化如图所示: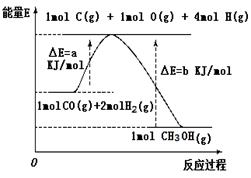
(1)写出合成甲醇的热化学方程式___________________________________________。
实验室在1 L的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 |
10 min |
20 min |
30 min |
40 min |
50 min |
60 min |
| 300 ℃ |
0.40 |
0.60 |
0.75 |
0.84 |
0.90 |
0.90 |
| 500 ℃ |
0.60 |
0.75 |
0.78 |
0.80 |
0.80 |
0.80 |
(2)在300 ℃反应开始10 min内,CO的平均反应速率为v(CO)=________________。
(3)在500 ℃达到平衡时,平衡常数K=________。
(4)在另一体积不变的密闭容器中,充入1.6 mol CO和2.0 mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半。计算该条件下H2的转化率为________。
(5)美国科学家成功开发便携式固体氧化物燃料电池,该燃料电池中一极通入空气,另一极通入甲醇气体,电解质是固态氧化物,在熔融状态下能传导O2—。在电路中每流过30 mol电子,有mol甲醇被完全氧化;在燃料电池中通甲醇的电极发生的电极反应为。
如右图,A为直流电源,c、d均为石墨电极, B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空: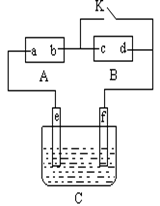
(1)电源A上的a为________极;
(2)滤纸B上发生的总化学方程式为___________________;
(3)欲在电镀槽中实现铁上镀锌,闭合K键,使c、d两点短路,则电极e上发生的反应为,电极f上发生的反应为___________________,槽中放的电镀液可以是。
(1)向H2S溶液中加入NaOH固体,H2S的电离平衡向(填左、右、不)移动,c(H+)(填增大、减小、不变),c(S2-)(填增大、减小、不变)。
(2) 若要使H2S溶液中c(HS-)增大,且使H2S的电离平衡逆向移动,可以加入。
(3)向H2S溶液中加水,c(HS-)(填增大、减小、不变),溶液pH(填增大、减小、不变)
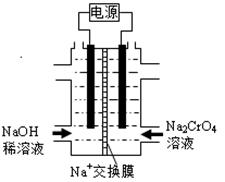
Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,
已知a+b=12,则:
该温度下,水的离子积常数Kw=。
该温度下,将10mL 0.1mol/L的稀硫酸与10mL 0.4mol/L的NaOH溶液混合后,溶液的pH=,此时该溶液中由水电离的c(OH-)=mol/L。(忽略体积变化)
Ⅱ. 根据2CrO42-(黄)+2H+ =Cr2O72-(橙)+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,电解一段时间后,右边溶液逐渐由黄色变为橙色。图中右侧电极连接电源的极,其电极反应式为,通电完成后,若转移0.1mol电子,则阴极区和阳极区的质量差为g。(已知电解前两极区溶液质量相同)