反应A(g)+3B(g)  2C(g)(正反应为放热反应),达平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
2C(g)(正反应为放热反应),达平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
| A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动 |
| B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动, |
| C.正反应速率和逆反应速率都变小,平衡向正反应方向移动 |
| D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动 |
某可充电电池的原理如下图所示,已知a、b为惰性电极,溶液 呈酸性。充电时右槽溶液颜色由绿色变为紫色。下列叙述正确的是
| A.充电时,b极接直流电源正极,a极接直流电源负极 |
| B.充电过程中,a极的电极反应式为:VO2++2H++e- = VO2++H2O |
| C.放电时,H+从左槽迁移进右槽 |
| D.放电过程中,左槽溶液颜色由黄色变为蓝色 |
将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:
| 实验 编号 |
温度/℃ |
平衡常数 /mol-1·L |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| SO2 |
O2 |
SO2 |
O2 |
||||
| 1 |
T1 |
K1 |
4 |
2 |
x |
0.8 |
6 |
| 2 |
T2 |
K2 |
4 |
2 |
0.4 |
y |
t |
下列说法不正确的是
A.x= 2.4
B.T1、T2的关系:T1 > T2
C.K1、K2的关系:K2 > K1
D.实验1在前6min的反应速率υ(SO2)="0.2" mol·L-1·min-1
X、Y、Z、M为原子序数依次增大的4种短周期元素。已知X、Y、Z是同周期的相邻元素,M原子的核外电子数是Z原子最外层电子数的2倍,Y与其同主族的短周期元素可形成一种常见的气体。下列说法正确的是
| A.原子半径:M>X>Y>Z |
| B.对应氢化物的沸点:M>Z>Y>X |
| C.对应氢化物的稳定性:Z>X>Y>M |
| D.XY2与MY2溶于水都能得到对应的酸 |
用下图所示实验装置进行相应实验,能达到实验目的的是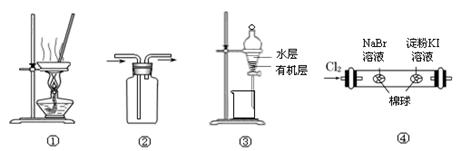
| A.用图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| B.按装置②所示的气流方向可用于收集H2、NH3等 |
| C.用图③所示装置,分离CCl4萃取I2水后的有机层和水层 |
| D.用图④所示装置,可以证明氧化性:Cl2>Br2>I2 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol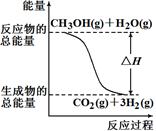
根据上述反应,下列说法正确的是
| A.上图表示反应①中的能量变化 |
| B.可推知2H2(g)+O2(g)=2H2O(g)ΔH=-483.8 kJ/mol |
| C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ |
| D.CH3OH转变成H2的过程一定要吸收能量 |