下列关于实验现象的描述不正确的是( )
| A.铜锌组成原电池中电子是从锌经过导线流向铜 |
| B.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D.把锌片放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
分子式为C4H8O3的有机物,一定条件下具有如下性质:①在浓硫酸存在下,能分别与CH3CH2OH或CH3COOH反应;②在浓硫酸存在下,能脱水生成一种能使溴水褪色的物质,该物质只存在一种结构形式;③在浓硫酸存在下,能生成一种分子式为C4H6O2的五元环状化合物。则C4H8O3的结构简式为( )
| A.HOCH3COOCH2CH3 | B.CH3CH(OH)CH2COOH |
| C.HOCH2CH2CH2COOH | D.CH3CH2CH(OH)COOH |
下列实验现象与对应结论均正确的是( )
| 选项 |
操作 |
现象 |
结论 |
| A |
常温下将Cu片放入浓H2SO4中 |
生成刺激性气味气体 |
Cu与浓H2SO4反应生成SO2 |
| B |
Al2(SO4)3溶液中滴加过量氢氧化钡溶液 |
生成白色沉淀 |
Al(OH)3不溶于氢氧化钡溶液 |
| C |
向某溶液中加入KSCN溶液,再向溶液中加入新制氯水 |
溶液先不显红色,加入氯水后变红色 |
该溶液中含有Fe2+ |
| D |
向某溶液中加入CCl4,振荡后静置 |
液体分层,下层呈紫红色 |
该溶液中存在I- |
短周期金属元素甲~丁在元素周期表中的相对位置如表所示: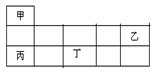
下列判断正确的是()
| A.原子半径:丙<丁<乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol—1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol—1
下列说法不正确的是( )
| A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ΔH=-Q,Q>574kJ·mol—1 |
| B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同 |
| C.若用标准状况下4.48L CH4还原NO2至N2,放出的热量为173.4kJ |
| D.若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总物质的量为1.6mol |
下列说法正确的是( )
| A.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 |
| B.CO2和SO2混合气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都有沉淀生成 |
| C.检验某酸性溶液中Cl-和SO42-,选用试剂及顺序是过量Ba(NO3)2溶液、AgNO3溶液 |
| D.用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |