在由Fe、FeO和Fe2O3组成的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+。则下列判断正确的是( )
| A.混合物中三种物质反应时消耗盐酸的物质的量之比为1:1:3 |
| B.反应后所得溶液中的Fe2+和Cl-的物质的量之比为1:3 |
| C.混合物中,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多0.02mol |
| D.混合物中,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多0.01mol |
某气态烃1 mol 恰好与2 mol HCl加成,生成物分子中的氢又可被6 mol Cl2取代,则此气态烃可能是
| A.C2H2 | B.C2H4 | C.CH≡C—CH3 | D.CH2=C(CH3)2 |
关于化学平衡常数、电离平衡常数、水的离子积常数和溶解平衡常数,下列说法正确的是
| A.四种平衡常数都是一个比值,没有单位 |
| B.四种平衡常数都是温度的函数,温度升高其值都增大 |
| C.一个化学反应的平衡常数与物质的计量数无关 |
| D.对于同类型反应,化学平衡常数K的大小反映了化学反应可能进行的程度 |
已知C5H11Br有8种同分异构体,则C6H12O属于醛的结构有
| A.16种 | B.11种 | C.8种 | D.6种 |
下列几组判断均正确的是
① 和
和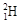 互为同位素②O2和O3互为同素异形体
互为同位素②O2和O3互为同素异形体
③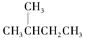 和
和 为同分异构体④
为同分异构体④ 和
和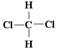 为同一物质
为同一物质
⑤ 和
和 为同系物⑥
为同系物⑥ 和
和 为芳香化合物
为芳香化合物
| A.①②④⑤ | B.①③④⑥ | C.①②⑤⑥ | D.②③④⑤ |
下列各溶液中,相关微粒物质的量浓度关系不正确的是
| A.0.1 mol·L-1NaHCO3溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-) |
| B.0.1 mol·L-1NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)=0.1 mol·L-1 |
| C.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| D.常温下,浓度为0.1 mol·L-1 NaHSO3溶液的pH<7:c(Na+)>c(HSO3-)>c(SO32-)> c(H+) |