下列各化合物中能发生酯化反应,且显酸性的是
| A.CH2=CH—CH2OH | B.HO—CH2—CH2—CH2—COOH |
| C.HNO3 | D.乙醇 |
甲酸和乙酸都是弱酸,当它们的浓度为0.10mol/L时,甲酸中的 约为乙酸中
约为乙酸中 的3倍。现有两种浓度不等的甲酸溶液
的3倍。现有两种浓度不等的甲酸溶液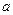 和
和 ,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为
,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为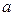 、乙酸、
、乙酸、 ,由此可知:
,由此可知:
A.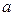 的浓度必小于乙酸的浓度 的浓度必小于乙酸的浓度 |
B.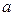 的浓度必大于乙酸的浓度 的浓度必大于乙酸的浓度 |
C.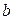 的浓度必小于乙酸的浓度 的浓度必小于乙酸的浓度 |
D.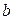 的浓度必大于乙酸的浓度 的浓度必大于乙酸的浓度 |
某温度下,在一容积可变的容器中,反应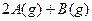

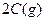 达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是:
达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是:
A、均减半 B、均加倍
C、均增加1mol D、均减小1mol
已知某氢氧化物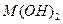 的溶度积常数为
的溶度积常数为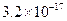 ,则
,则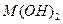 在水中的溶解度为:
在水中的溶解度为:
A. |
B.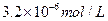 |
C.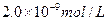 |
D.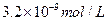 |
下列四组溶液的pH前者大于后者的是:
A.物质的量浓度相同的盐酸和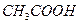 溶液 溶液 |
B.物质的量浓度相同的 溶液和氨水 溶液和氨水 |
C.pH=3的盐酸和pH=3的 溶液均稀释100倍所得溶液 溶液均稀释100倍所得溶液 |
D.pH=10的 溶液和pH=10的 溶液和pH=10的 溶液均稀释100倍所得溶液 溶液均稀释100倍所得溶液 |
已知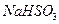 溶液呈酸性,
溶液呈酸性,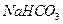 溶液呈碱性。现有浓度均为0.1mol/L的
溶液呈碱性。现有浓度均为0.1mol/L的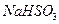 溶液和
溶液和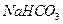 溶液,溶液中各粒子的物质的量浓度的关系中(R表示S或C),一定正确的是:
溶液,溶液中各粒子的物质的量浓度的关系中(R表示S或C),一定正确的是:
A、
B、
C、
D、两溶液中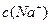 、
、 、
、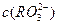 分别相等
分别相等