试谈谈饮水与健康?(提示:日常生活饮用的水有哪些?你认为饮用什么有益健康,为什么?)
“物质的组成和结构决定物质性质,物质的性质决定了物质的用途”。请分析:
(1)金刚石很硬,而石墨却很软。原因是
。
(2)氢氧化钠和氢氧化钡溶液都能使无色酚酞试液变红。原因是
。
(3)CO具有可燃性,可以做燃料;CO具有还原性,可以用来。
(答一点即可)
某有机化合物M,其分子式为AxByCz,且x+y+z=22。已知M放入水中即水解生成白色沉淀E和无色气体F。白色沉淀E不溶于氨水,能溶于氢氧化钠溶液。取0.1molM放入足量水中,能收集到9g气体F。将该气体在空气中完全燃烧,只生成26.4g二氧化碳和16.2g水,求:
(1)气体F的分子式。
(2)有机化合物M的分子式。
(3)写出M与过量的氢氧化钠溶液反应的化学方程式。
(1)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,
肼—空气燃料电池放电时:负极的电极反应式是:
(3)下图是一个电化学过程示意图。假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气L(假设空气中氧气体积含量为20%)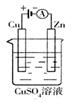
(8分)今有A、B、C、D四种元素,已知A元素是自然界中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第3周期第一电离能最小的元素,D元素在第3周期中电负性最大。
(1)试推断A、B、C、D四种元素的名称和符号。
(2)写出上述元素两两化合生成的常见化合物的化学式。
(12分)(1)下列原子的外围电子排布式(或外围轨道表示式)中,那一种状态的能量较低?并指出处于能量较低状态时原子中的未成对电子数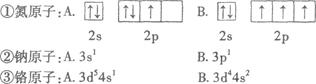
(2)31号元素镓(Ga)是半导体材料之一。
①写出镓原子的电子排布式,指出镓元素在元素周期表中的位置。
②写出镓元素的最高价氧化物、氯化物的化学式。