有一种硬水和一种软水,请用家庭中常使用的物品检验之(两种方法)。
;请写出己烷(C6H14)的同分异构体的结构简式。
80℃时,将0.40mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2,△H >0隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2,△H >0隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |





 (1)计算0s—20s内用N2O4表示的平均反应速率为 mol·L-1·s-1
(1)计算0s—20s内用N2O4表示的平均反应速率为 mol·L-1·s-1

 (2)要增大N2O4的转化率,同时增大该反应的K值,可采取的措施有 (填序号)
(2)要增大N2O4的转化率,同时增大该反应的K值,可采取的措施有 (填序号) A.通入一定量的NO2气体
A.通入一定量的NO2气体 B.通入一定量的氦气以增大压强
B.通入一定量的氦气以增大压强 C.使用高效催化剂
C.使用高效催化剂 D.升高温度
D.升高温度 (3)如图是80℃时容器中N2O4物质的量的变化
(3)如图是80℃时容器中N2O4物质的量的变化 曲线,请在该图中补画出该反应在60℃时
曲线,请在该图中补画出该反应在60℃时 N2O4物质的量的变化曲线。
N2O4物质的量的变化曲线。
[化学选修——2:化学与技术]我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、FeO、Fe2O3等。一种利用粉煤灰制取氧化铝、硫酸铁溶液、二氧化硅的工艺流程如下: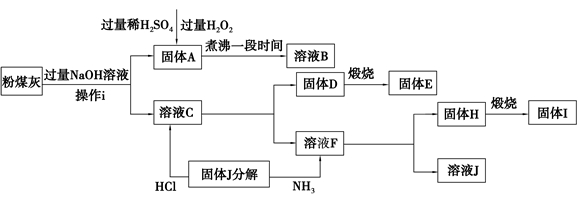
(1)操作i的名称为 。
(2)工业上若需加快粉煤灰与NaOH溶液反应的浸出速率,可采取的措施有 (写两点即可)。
(3)写出固体A溶解在稀硫酸中所得溶液与H2O2反应的离子方程式 。
(4)以上流程中可以循环利用的物质是 (填化学式)。
(5)某科研小组用硫酸作为浸取液,浸取粉煤灰中的铝元素和铁元素,在104℃用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为 h;铝的浸取率与的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在相同时,浸取率最高的是 (填化学式)。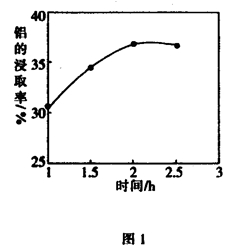

(6)Al/AgO电池是一种新型安全电池,广泛用于军事领域,其电池总反应为:2Al + 3AgO + 2OH―+ 3H2O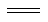 2[Al(OH)4]―+ 3Ag,则该电池工作时正极的电极反应方程式为 ,若电池产生6mol电子转移,整体上分析电池负极消耗的OH―物质的量最终为 mol。
2[Al(OH)4]―+ 3Ag,则该电池工作时正极的电极反应方程式为 ,若电池产生6mol电子转移,整体上分析电池负极消耗的OH―物质的量最终为 mol。
【选修2:化学与技术】材料是人类赖以生存和发展的重要物质基础,回答下列问题:
(1)下列生产工艺能获取新型无机非金属材料的是(填序号)
①采用甲烷为原料,在微波和其他条件下生产金刚石
②在玻璃生产过程中加人K、Pb生产其有特殊用途的光学玻璃
③在水泥生产过程中加入高炉矿渣生产特殊用途的水泥
④采用传统方法用焦炭还原SiO2制备单晶硅
(2)某炼铁高炉中一次投入磁铁矿冶炼生铁,若不考虑其他的的反应,也不考虑生铁中的杂质,则炼得的生铁为3.36 t.,该过程中转移的电子数为 mol,生铁中含碳、硫等元素较多,炼钢是以生铁为原料,除去过多的碳、硫等杂质元素,其中除去硫的化学方程式为
(3)工业炼金属铝的工艺流程如下:
该工艺中冰晶石和氟化钙的作用是 ,物质W的化学式为
(4)金属腐蚀带来的损失无法估量。钢铁腐蚀多为吸氧腐蚀,其正极反应式为 _
二甲醚(DME)一种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为Cu0/Zn0/Al2 O2):2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
(1)若反应在恒温、恒压下进行,以下叙述能说明该反应达到平衡状态的是 。
| A.CO和H2的物质的量浓度比是1:2 |
| B.CO的消耗速率等于CH3OCH3的生成速率的2倍 |
| C.容器中混合气体的体积保持不变 |
| D.容器中混合气体的平均摩尔质量保持不变 |
E.容器中棍合气体的密度保持不变
(2)600℃时,一步法合成二甲醚过程如下:
CO(g)+2H2(g)=CH3OH(g) △H1=-100.46kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-38.7kJ/mol
则△H2= 。
(3)复合催化剂的制备方法之一是Na2 C03共沉淀法:制备1 mol/L的硝酸铜,硝酸锌和硝酸铝的水溶液。然后向盛有去离子水的烧杯中同时滴加混合硝酸盐溶液和1 mol/L的Na2C03水溶液,70℃下搅拌混合。沉淀后过滤,洗涤沉淀物,80℃下干燥12小时,然后500℃下焙烧16小时。请写出上述过程中硝酸铝与Na2C03水溶液反应的离子方程式:
(4)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的 (填正、负)极,通DME的电极反应为 。