电负性的大小也可以作为判断金属性和非金属性强弱的尺度,下列关于电负性的变化规律正确的是
| A.周期表中同周期元素从左到右,元素的电负性逐渐增大 |
| B.周期表中同主族元素从上到下,元素的电负性逐渐增大 |
| C.电负性越大,金属性越强 |
| D.电负性越小,非金属性越强 |
有一未完成的离子方程式:□□+ XO3-+6H+═3X2+3H2O,据此判断X元素的最高化合价为
| A.+7 | B.+6 | C.+5 | D.+1 |
下列说法不正确的是
| A.将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 |
B.0.1mol 的NaHCO3溶液中 的NaHCO3溶液中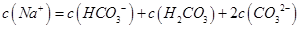 |
C.0.1mol 的NaHA溶液Ph=5,则溶液: 的NaHA溶液Ph=5,则溶液: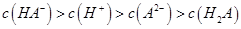 |
D.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液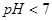 |
下列推断正确的是
| A.CO、NO、NO2都是大气污染的气体,在空气中都能稳定存在 |
| B.Na2O、Na2O2组成元素相同,两化合物中阴阳离子个数比也相同 |
| C.SiO2是酸性氧化物,只能与碱反应而不能与酸反应 |
| D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红 |
设阿伏加德罗常数的数值为NA,下列说法正确的是
A.80mL 10mol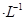 浓盐酸与足量MnO2反应,转移电子数为0.4NA 浓盐酸与足量MnO2反应,转移电子数为0.4NA |
| B.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
| C.1 mol A13+含有核外电子数为3NA |
| D.常温下,16g CH4中共用电子对的数目为4NA |
某同学按右图所示的装置进行实验,A、B为两种常见金属,它们的硫酸盐可溶于水。当K闭合时,在交换膜处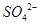 从右向左移动。下列分析正确的是
从右向左移动。下列分析正确的是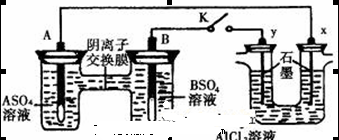
A.B的电极反应: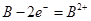
B.溶液中A2+浓度减小
C.y电极上有H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解