下列说法中正确的是 ( )
| A.双原子分子中化学键键能越大,分子越牢固 |
| B.双原子分子中化学键键长越长,分子越牢固 |
| C.双原子分子中化学键键角越大,分子越牢固 |
| D.在同一分子中,σ键要比π键的分子轨道重叠程度一样多,只是重叠的方向不同 |
在可逆反应mA(g)+nB(g)  pC(g);△H<0中m、n、p为系数,且m+n>p。分析下列各图,在平衡体系中A的质量分数与温度t℃、压强P关系正确的是()
pC(g);△H<0中m、n、p为系数,且m+n>p。分析下列各图,在平衡体系中A的质量分数与温度t℃、压强P关系正确的是()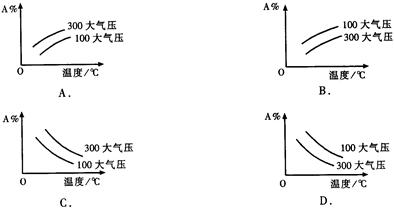
金属钾和金属钠的金属性相近,但K比Na略强,当利用金属钠与KCl共熔制金属钾时,发现钾与钠的共熔体难以分离,如调整温度到一定程度,则可利用钠与KCl反应制取K,下面是四种物质的熔沸点:
_K Na KClNaCl
熔点(℃) 63.6 97.8 770 801
沸点(℃) 774 882.9 1500 1413
根据平衡移动原理,可推知用Na与KCl反应制取金属钾的适宜温度是
| A.低于770℃ | B.850℃ | C.高于882.9℃ | D.1413~1500℃ |
在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是
| A.平衡向正反应方向移动了 | B.物质A的转化率增大了 |
| C.物质B的质量分数增加了 | D.a>b |
对于3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),若起始投入3mol铁、4mol水汽在体积为0.5L的密闭容器中反应,平衡时氢气的物质的量浓度4mol·L-1,则化学平衡常数为
Fe3O4(s)+4H2(g),若起始投入3mol铁、4mol水汽在体积为0.5L的密闭容器中反应,平衡时氢气的物质的量浓度4mol·L-1,则化学平衡常数为
| A.1/3 | B.1/6.75 | C.1/27 | D.1 |
某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)  2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
A.平衡不移动
B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,C的体积分数增大
D.再达平衡时,正反应速率增大,逆反应速率减小