(16分) 化合物A(分子式为C9H9O2Br)在一定条件下有如下的转化关系,其中1mol C与Na完全反应生成1 mol H2,若与NaHCO3完全反应能产生1mol CO2,D和E互为同分异构体,但D可以使溴的四氯化碳溶液褪色,而E分子中有一个苯环和一个五元环。
(1)写出A含有官能团的名称: ;
(2)H可能是(写名称):________________________________________________ __;
(3)写出②、③的反应类型:②__________________、③__________________;
(4)写出E、G的结构简式E G ;
(5)反应⑤的化学方程式:
(6)同时满足下列条件的C的同分异构体有_________ 种:
①能发生银镜反应;②1mol该物质可以消耗3molNaOH; ③苯环上的一氯代物有3种。
下图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置。
试回答:
(1)C、D、G三个装置所盛放的试剂分别是:
C_____________________________________________________
D___________
G
(2)F中的现象为___________________________,生成物是________。
(3)写出在A、E、G中发生反应的化学方程式为:
A:;
E:;
G:
某学生设计了一个“黑笔写红字”的趣味实验,如图所示。滤纸先用氯化钠、无色酚酞
的混合液浸湿,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,回答下列问题:
(1)①a端是极②铂片是极
(2)①铅笔端除了出现红色字迹,还有的现象是。
②检验铂片的产物的方法是。
下图表示一个精炼粗铜的电解池,电解液a选用CuSO4溶液,X、Y是两块电极板,通过导线与直流电源相连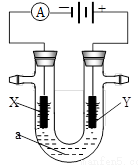
请回答以下问题
(1)Y电极的材料是,
(2)电极反应式是,
(3)X电极的现象是。
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,
则
(1)在10S内Z的平均速率为,
(2)该反应的化学方程式。
(1)1g 硫粉在O2中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式
。
(2)若2.6 g 乙炔(C2H2,气态)完全燃烧生成液态水和CO2(g)时放热130 kJ。则乙炔燃烧的热化学方程式为。