运用相关原理,回答下列各小题:
已知:NaHSO4在水中的电离方程式为 NaHSO4=Na+ + H+ + SO42-
(1)常温下,pH=5的NaHSO4溶液中水的电离程度 pH=9的NH3·H2O中水的电离程度。(填 “>”、“=”或“<”)
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为 。(用离子方程式表示);若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则[Na+]+[NH4+] 2[SO42-](填 “>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。(填“>”、“=”或“<” )
(3)将分别含有MnO4-、Fe3+、Fe2+、I-的四种溶液混合,调节溶液的pH值,使pH=1,
充分反应后:
①若I-离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是 。
②若所得混合液呈紫色,上述四种离子在溶液中一定存在的有 ,
一定不存在的离子有 。
Ⅰ、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的
放电电压。高铁电池的总反应为
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
(1) 放电时正极附近溶液的碱性 (填增强、减小或不变);放电时每转移3 mol 电子,有 molK2FeO4被(填氧化或还原)
(2)电池充电时阳极反应为
Ⅱ、下列框图中,A由两种黑色金属氧化物等物质的量混合而成,B中含有四种阳离子.据此回答下列问题:
(1)A的组成是(填化学式)
(2)相同条件下,溶液B中所有阳离子的氧化性由强到弱的顺序依次是
(3)A中某组分可由单质与水反应制得,化学方程式为:
(4)电解所用装置如右图所示
电解开始阶段,阳极上的电极反应是
电解至阴极刚开始有固体R析出时,该溶液中金属离子浓度由大到小的顺序是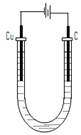
磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白粉的下脚料(含大量FeSO4的废液)为原料来制备磁材氧化铁。
已知:煅烧中的化学反应方程式为:FeCO3 → FeO + CO2↑,4FeO + O2 → 2Fe2O3
(1)用98%的H2SO4的配制500mL的20%的H2SO4,所需玻璃仪器是
| A.玻璃棒 | B.烧杯 | C.漏斗 | D.250mL容量瓶 |
E.500mL容量瓶 F.胶头滴管
(2)浓缩结晶后得到的晶体是 (填化学式),A中溶质是 ;此溶液中各
离子的浓度比较大小为: 。
(3) 20%H2SO4和铁皮的作用分别是 。
(4)检验滤液中含有NH4+的方法是 。
(5)写出步骤“合成”中发生的化学变化(用化学方程式表示): 。
已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示。
(1)95 ℃时水的电离平衡曲线应为 (填“A”或“B”),理由是 。
(2)曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH 7。
(3)在曲线B所对应的温度下,将0.02 mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH= 。
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化: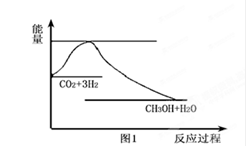
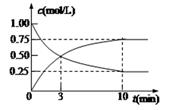
图2
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)= ;
②下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式: 。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极的电极反应式是: 。
已知某无色透明溶液中仅含有包括Na+和CH3COO— 在内的四种离子。
请回答下列问题。
(1)该溶液中的溶质可能有三种情况,请分别写出各种情况的化学式:
① ;② ; ③ 。
(2)用离子方程式表示CH3COONa溶液显碱性的原因: ;
(3)当溶液中各离子浓度大小的顺序为c(CH3COO—)>c(Na+)>c(H+)>c(OH—)时,则该溶液可能是 (填序号);
A.由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成
B.由0.1mol/L的CH3COONa溶液与0.1mol/L的NaOH溶液等体积混合而成
C.由0.1mol/L的CH3COONa溶液与0.1mol/L的CH3COOH溶液等体积混合而成
(4)当该溶液中溶质为两种,且溶液呈碱性时,四种离子的物质的量浓度由大到小的排列顺序可能为(写出两种):① 、 ② 。