下列晶体中由原子直接构成的单质有( )
| A.硫 | B.氦气 | C.金刚石 | D.金属镁 |
在一定条件下,将64 g二氧化硫气体氧化成三氧化硫气体时,实验测得放出热量为78.64 kJ,已知二氧化硫在此条件下的转化率为80%。下列热化学方程式书写正确的是( )
A.SO2(g)+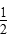 O2(g) O2(g)  SO3(g)ΔH=-98.3 kJ·mol-1 SO3(g)ΔH=-98.3 kJ·mol-1 |
B.2SO2(g)+O2(g)  2SO3(l)ΔH=-196.6 kJ·mol-1 2SO3(l)ΔH=-196.6 kJ·mol-1 |
C.SO2(g)+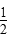 O2(g) O2(g)  SO3(g)ΔH=-78.64 kJ·mol-1 SO3(g)ΔH=-78.64 kJ·mol-1 |
D.2SO2(g)+O2(g)  2SO3(g)ΔH=+196.6 kJ·mol-1 2SO3(g)ΔH=+196.6 kJ·mol-1 |
氯原子对O3分解有催化作用:O3+Cl=ClO+O2 ΔH1,ClO+O=Cl+O2ΔH2,大气臭氧层的分解反应是:O3+O=2O2 ΔH,该反应的能量变化示意图如图所示,下列叙述中,正确的是( )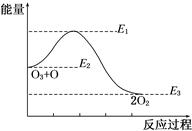
| A.反应O3+O=2O2的ΔH=E1-E3 |
| B.反应O3+O=2O2的ΔH=E2-E3 |
| C.O3+O=2O2是吸热反应 |
| D.ΔH=ΔH1+ΔH2 |
对水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的解释,说法正确的是( )
| A.Mg(OH)2的溶度积大于MgCO3的溶度积,且在水中发生了沉淀转化 |
| B.Mg(OH)2比MgCO3更难溶,且在水中发生了沉淀转化 |
C.MgCO3电离出的CO 发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀 发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀 |
D.MgCO3电离出的CO 发生水解,促进水中OH-浓度增大,对Mg(OH)2沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀 发生水解,促进水中OH-浓度增大,对Mg(OH)2沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀 |
有体积相同、pH相等的烧碱溶液和氨水,下列叙述中正确的是( )
| A.两溶液物质的量浓度相同 |
| B.用同浓度的盐酸中和时,消耗盐酸的体积相同 |
| C.两溶液中OH-浓度相同 |
| D.加入等体积的水稀释后,pH仍相等 |
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于( )
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |