在100℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,发生反应:2NO2 N2O4。每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
N2O4。每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间/s |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
(1)在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为________mol/(L·s)。
(2)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是_________mol/L。假设在80s时达到平衡,请在右图中画出该条
件下N2O4和NO2的浓度随时间变化的曲线。
(3)上述(2)达到平衡后四氧化二氮的转化率为_________,混合气体的平均摩尔质量为___________。
(4)达到平衡后,如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,则平衡将 (填“向左移动”、“向右移动”或“不移动”)。
将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
A组:_________________________________。B组:_________________________________。
(7分)已知:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,用双线桥法标出上述电子转移的方向和数目:__ _。上述反应中还原剂是________;氧化剂是_______。
(6分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.加热分解法 | C.结晶法 | D.分液法 E.蒸馏法 F.过滤法 |
(1)________分离饱和食盐水与沙子的混合的。
(2)________从KNO3和NaCl的混合溶液中获得KNO3。
(3)________分离水和汽油的混合物。
(4)________分离四氯化碳(沸点76.75℃)和甲苯(沸点110.6℃)的混合物。
(5)________从碘的水溶液里提取碘。
(6)________从NaCl与NH4HCO3固体混合物中得到NaCl。
(9分)有化合物:
(1)请写出丙中含氧官能团的名称:______________。
(2)请判别上述哪些化合物互为同分异构体:__________________________________。
(3)请按酸性由强到弱排列甲、乙、丙的顺序。
(10分)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为______________,名称为___________________________________。
(2)A中的碳原子是否都处于同一平面?________(填“是”或“不是”);A分子是否存在顺反异构体________(填“是”或“否”)。
(3)已知A、B、C有如下转化关系: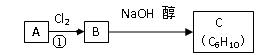
|
 ;
;