已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
| A.能使PH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 |
| B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
| C.向NaClO溶液中通入少量二氧化碳的离子方程式: 2ClO-+CO2+H2O=2HClO+CO32- |
| D.向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl- |
今有H2、CO、CH4的体积比为1∶1∶2的混合气体V L,当其完全燃烧时,需O2的体积为()
| A.1.25V L | B.4V L | C.V L | D.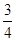 V L V L |
1 mol甲烷和一定量氯气在光照下反应,恰好反应生成了等物质的量的四种氯代甲烷,则消耗氯气的物质的量为()
| A.2mol | B.2.5mol | C.3mol | D.5mol |
结构简式为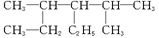 的物质,其名称是()
的物质,其名称是()
| A.2,4-二甲基-3-乙基已烷 | B.3-甲基-2,3-二乙基戊烷 |
| C.2-甲基-2,3-二乙基戊烷 | D.3,5-二甲基-4-乙基已烷 |
下列各组物质中,互为同分异构体的是()
| A.氧气和臭氧 | B.氕和氘 |
| C.丙烷和2-甲基丙烷 | D.2,3-二甲基丁烷和已烷 |
下列各组物质属于同分异构体的是()
| A.2-溴丙烷与-2-溴丁烷 | B.氧气与臭氧 |
| C.2-甲基丙烷与丁烷 | D.水与重水 |