200℃时,11.6 g CO2和水蒸气的混合气体与过量的Na2O2充分反应后,固体质量增加了3.6 g,再将反应后剩余固体冷却后加入含有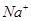 、
、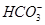 、
、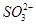 、
、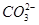 等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是 ( )
等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是 ( )
| A.原混合气体的平均摩尔质量为23.2 g/mol |
| B.混合气体与Na2O2反应过程中电子转移的物质的量为0.25 mol |
C.溶液中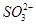 的物质的量浓度基本保持不变 的物质的量浓度基本保持不变 |
D.溶液中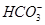 的物质的量浓度减小, 的物质的量浓度减小,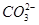 的物质的量浓度增大,但是 的物质的量浓度增大,但是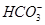 和 和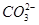 的物质的量浓度之和基本保持不变 的物质的量浓度之和基本保持不变 |
在恒温恒容条件下,能使A(g)+B(g) C(g)+D(g)正反应速率增大的措施是()
C(g)+D(g)正反应速率增大的措施是()
| A.减小C或D的浓度 | B.增大D的浓度 |
| C.减小B的浓度 | D.增大A或B的浓度 |
可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是()
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是()
| A.3v正(N2)=v正(H2) | B.v正(N2)=v逆(NH3) |
| C.2v正(H2)=3v逆(NH3) | D.v正(N2)=3v逆(H2) |
在mA+Nb====pC的反应中,m、n、p为各物质的化学计量数,现测得C每分钟增加a mol·L-1,B每分钟减少1.5a mol·L-1,A每分钟减少0.5a mol·L-1,则m∶n∶p为()
| A.2∶3∶2 | B.2∶2∶3 |
| C.1∶3∶2 | D.3∶1∶2 |
铜片和锌片用导线连接后插入稀硫酸中,锌片是()
| A.阴极 | B.正极 | C.阳极 | D.负极 |
可逆反应2A(g)+3B(g) 3C(g)在一定条件下,使一定量的A气体和B气体发生反应,达到平衡状态时,具有的性质是()
3C(g)在一定条件下,使一定量的A气体和B气体发生反应,达到平衡状态时,具有的性质是()
A.各物质的浓度之比c(A)∶c(B)∶c(C)=2∶3∶3
B.平衡混合物的体积是反应开始时的35
C.平衡混合物中各物质的浓度相等
D.单位时间内,若消耗了a mol A物质,同时也消耗了1.5a mol C物质