用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作: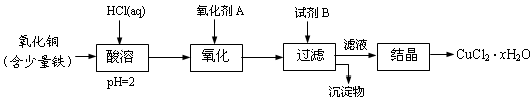
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)氧化剂A可选用_______(填编号,下同)
① Cl2 ② KMnO4 ③ HNO3 ④ H2O2
(2)要得到较纯的产品,试剂B可选用_______
① NaOH ② FeO ③ CuO ④Cu2(OH)2CO3
(3)试剂B的作用是______
① 提高溶液的pH ② 降低溶液的pH ③ 使Fe3+完全沉淀 ④ 使Cu2+完全沉淀
(4)从滤液经过结晶得到氯化铜晶体的方法是_________(按实验先后顺序选填编号)
① 过滤 ② 蒸发浓缩 ③ 蒸发至干 ④ 冷却
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n g。
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为n g。
试评价上述两种实验方案,其中正确的方案是______,据此计算得x = _________(用含m、n的代数式表示)。
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl,再烘干、焙烧除去水分得到粉体TiO2 。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·xH2O的化学方程式为▲。
⑵ 检验TiO2·xH2O中Cl-是否被洗净的方法是▲。
⑶配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是▲;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的▲(填字母代号)。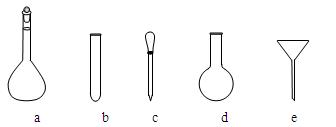
⑷滴定终点的现象是▲。
⑸滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为▲。
⑹判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果▲。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果▲
锂离子电池的广泛应用使回收利用锂资源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:
(1)第②步反应得到的沉淀X的化学式为。
(2)第③步反应的离子方程式是。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有。
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
、。
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1 g,第③步反应中加入20.0mL 2.5mol·L-1的H2SO4溶液。正极材料中的锂经反应③和④完全转化为Li2CO3,至少有g Na2CO3参加了反应。
仔细阅读下图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)。请按要求回答:
(1)反应①既是分解反应,又是氧化还原反应,产物B、D、E、F的物质的量之比1:1:1:14。A强热分解的化学反应方程式为▲。
(2)写出反应②在工业生产上的一种用途:▲。
(3)反应③的离子方程式为▲;
反应④的化学方程式为▲。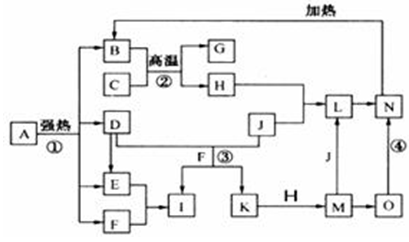
欲用浓硝酸法测定某铜银合金中铜的质量分数(测定反应后生成气体的量),但资料表明:①反应中除生成NO2气体外还有少量NO生成;②常温下NO2和N2O4混合存在,在低于0℃时,几乎只有无色的N2O4液体或晶体存在。为完成测定并验证确有NO生成,有人设计了如图所示的实验装置。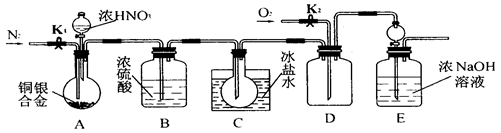
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是__________________________。
(2)装置中B瓶的作用是。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是_____________。
(4)为减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是___________。
(5)C装置烧瓶中的物质是,用简单的实验证实你的判断:。
(6)实验已测出一定质量的铜银合金完全反应后E装置的生成物中含氮元素的质量,为确定合金中铜的质量分数还需测定的数据是______________________。
利用下图装置采用适当试剂可完成实验某探究实验,并得出相应实验结论,实验所用试剂或所得结论列于表中。请回答: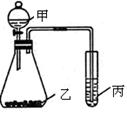
| 实验试剂 |
实验结论 |
||
| 甲 |
乙 |
丙 |
|
| ① |
高锰酸钾 |
② |
氧化性:KMnO4>Cl2>Br2 |
 (1)图中①为,②为。
(1)图中①为,②为。 (2)请你根据上述实验装置再设计一个实验,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表;(不允许再验证氧化性顺序)
(2)请你根据上述实验装置再设计一个实验,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表;(不允许再验证氧化性顺序)
| 试剂甲 |
试剂乙 |
试剂丙 |
丙中现象 |
实验结论 |