在一定条件下,将1 molCO和1 mol水蒸气通入容器中发生下述反应:CO+H2O CO2+H2,达到平衡后,测得为CO20.6 mol,再通入0.3 mol水蒸气,又达到平衡后,CO2的物质的量为
CO2+H2,达到平衡后,测得为CO20.6 mol,再通入0.3 mol水蒸气,又达到平衡后,CO2的物质的量为
| A.0.7mol | B.0.8mol | C.0.6mol | D.0.9mol |
下列各组热化学方程式中Q1大于Q2(Q1、Q2为正值)的有()
①HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-Q1kJ·mol-1
HAc(aq)+KOH(aq)=HAc(aq)+H2O;△H=-Q2kJ·mol-1
②C(s)+ O2(g)=CO(g);△H=-Q1kJ·mol-1
O2(g)=CO(g);△H=-Q1kJ·mol-1
C(s)+O2(g)=CO2(g);△H=-Q2kJ·mol-1
③4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ·mol-1
④H2(g)+ O2(g)=H2O(g);△H=-Q1kJ·mol-1
O2(g)=H2O(g);△H=-Q1kJ·mol-1
H2(g)+ O2(g)=H2O(l);△H=-Q2kJ·mol-1
O2(g)=H2O(l);△H=-Q2kJ·mol-1
| A.①② | B.③④ | C.②④ | D.①③ |
下列反应的离子方程式正确的是()
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体: |
| B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
C.实验室用浓盐酸与MnO2反应制Cl2: |
| D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
已知pH=1的某溶液中存在较多的Ba2+、NO3-,则该溶液中还可能大量存在的离子组是()
| A.Fe3+、F-、Cl- | B.Mg2+、SO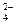 、Br- 、Br- |
| C.Mg2+、Cl-、Fe2+ | D.Na+、NH 、Cu2+ 、Cu2+ |
锰的氧化物MnO2、Mn2O3、Mn3O4,Mn2O7在加热时均能和浓盐酸反应生成MnCl2和Cl2。现11.45 g锰的某种氧化物跟足量的盐酸反应,产生的氯气在标准状况下的体积为1.12 L,则参加反应的氧化物是( )
| A.MnO2 | B.Mn2O3 | C.Mn3O4 | D.Mn2O7 |
在一含Na+的澄清溶液中,可能还 存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉溶液变蓝色。根据上述实验事实推断,下列说法不正确的是 ()
存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉溶液变蓝色。根据上述实验事实推断,下列说法不正确的是 ()
| A.溶液中一定存在Br-、CO32- | B.溶液中可能存在NH4+ |
| C.溶液中一定不存在Fe2+、I-、SO32- | D.溶液一定呈碱性 |