将等物质的量的A.B混合于2L的密闭容器中,发生下列反应3A(g)+B(g) xC(g)+2D(g),经反应5min后,测知D的浓度为0.5mol/L,A.B的物质的量浓度之比为3∶5,C的平均反应速率是0.1mol/(L·min),试计算:
xC(g)+2D(g),经反应5min后,测知D的浓度为0.5mol/L,A.B的物质的量浓度之比为3∶5,C的平均反应速率是0.1mol/(L·min),试计算:
(1)x的值?
(2)5min内B的平均反应速率?
(3)5min时A的物质的量浓度?
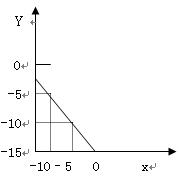
在100毫升NaOH溶液中加入NH4NO3和(NH4)2SO4固体混合物,加热充分反应。如图表示加入的混合物质量和产生的气体体积(标况)的关系。试计算:
(1)写出NaOH溶液与NH4NO3和(NH4)2SO4固体反应的离子方程式,求出NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140mL,固体混合物的质量是51.6g时,充分反应后,生成气体的体积(标况)为多少L?
(3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g时,充分反应后,生成气体的体积(标况)为多少L?
硫铁矿在高温下被氧气氧化并产生SO2气体:4FeS2+11O2→8SO2+2Fe2O3。设空气中N2占4/5、O2占1/5,试完成下列各题:
(1)55L空气和足量FeS2完全反应后,气体体积(同温同压下,下同)变为L。
(2)若所得混合气体中SO2的体积分数为0.08,则所得混合气体中O2的体积分数。
充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍。
(1)求该有机物的分子式。
(2)写出该有机物可能的同分异构体的结构简式
(3)若在核磁共振氢谱中只有一个信号峰,确定该有机物的结构,并用键线式表示。
某元素的同位素X,它的氯化物XCl 1.49g溶于水制成溶液后,加入1mol·L-1的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,试通过计算确定(写出计算过程):
(1)X元素在周期表中的位置;
(2)把一小粒X的单质放入水中,有何现象? 写出反应的化学方程式。
某温度下的溶液中c (H+)=1.0×10x mol/L,c (OH-)=1.0×10y mol/L。x与y的关系如右图所示:
(1)求该温度下,中性溶液的pH;
(2)求该温度下0.01mol/LNaOH溶液的PH;
(3)该温度下,pH=a的醋酸溶液与pH=b的NaOH溶液等体积混合,恰好完全反应,求此醋酸溶液中醋酸的电离度。