下列叙述正确的是
| A.硅是一种重要的非金属单质,可用于制造太阳能电池 |
| B.硫在足量的空气中燃烧生成SO3 |
| C.钠在空气中燃烧生成氧化钠 |
| D.与同浓度稀盐酸反应的速率:Na2CO3>NaHCO3 |
单晶硅是制作电子集成电路的基础材料。科学家预计,到2011年一个电脑芯片上将会集成10亿个晶体管,其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为:
①SiO2 + 2C Si + 2CO②Si + 2Cl2
Si + 2CO②Si + 2Cl2 SiCl4③SiCl4 + 2H2
SiCl4③SiCl4 + 2H2 Si + 4HCl,
Si + 4HCl,
其中反应①和③属于()
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
用NA表示阿伏德罗常数,下列叙述正确的是()
| A.标准状况下,22.4LH2O含有的分子数为1 NA |
| B.常温常压下,16g O2含有的分子数为0.5 NA |
| C.通常状况下,1 NA个SO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5mol/L的K2CO3溶液中,含有CO32-个数为0.5 NA |
“垃圾是放错了位置的资源”,应该分类回收。生活中废弃的铁锅、铝制的易拉罐、铜导线等可以归为一类加以回收,它们属于()
| A.氧化物 | B.盐 | C.碱 | D.金属或合金 |
在一密闭容器中进行如下反应:2SO2(气)+O2(气) 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是()
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是()
| A.SO2为0.4mol/L、O2为0.2mol/L | B.SO2为0.25mol/L |
| C.SO2、SO3均为0.15mol/L | D.SO3为0.25mol/L |
可以充分说明反应P(g)+Q(g)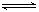 R(g)+S(g)在恒温下已达到平衡()
R(g)+S(g)在恒温下已达到平衡()
| A.反应容器内的P、Q、R、S的浓度不随时间改变 |
| B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 |
| D.反应容器内的气体总物质的量不随时间变化 |