常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使甲醛呈红色的溶液:NH4+、Ba2+、HCO3-、Cl- |
| B.c(H+)=10-12mol/L的溶液:K+、Ba2+、Br-、Cl- |
| C.1.0mol/L的KNO3溶液:H+、Fe2+、SO42-、Cl- |
| D.与Al反应能产生H2的溶液:NH4+、SO32-、AlO2-、I- |
已知4种无机化合物在水中和液氨中的溶解度(g/100g溶剂)为: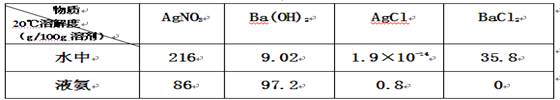
由此溶解度可知在水溶液中上述化合物发生复分解反应为:2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2,那么上述几种化合物在液氨溶液中发生复分解反应的化学方程式()
| A.2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2 | B.2AgNO3+BaCl2=2AgCl+Ba(NO3)2↓ |
| C.2AgCl+Ba(NO3)2=2AgNO3↓+BaCl2 | D.2AgCl+Ba(NO3)2=2AgNO3+BaCl2↓ |
高温下,某反应达平衡,平衡常数K=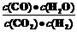 。恒容时,温度升高,H2浓度减小,下列说法正确的是 ()
。恒容时,温度升高,H2浓度减小,下列说法正确的是 ()
| A.该反应的焓变为正值 | B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 | D.该反应化学方程式为CO+H2O CO2+H2 CO2+H2 |
下列实验操作或原理不正确的是 ( )
| A.纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 |
| B.抽滤时,滤纸要小于布氏漏斗 |
| C.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 |
| D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
下列说法中,正确的是( )
| A.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
| B.凡是能自发进行的化学反应,一定是△H<0、△S>0 |
| C.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,须经润洗后方可使用 |
| D.Ksp与难溶电解质的性质、温度、溶液中的离子浓度等因素有关 |
下列各组混合物的分离或提纯,方法不正确的是( )
| A.除去N2中的O2 ——(通过灼热的铜网) |
| B.除去Fe(OH)3胶体中的NaCl——(过滤,洗涤,干燥) |
| C.除去CuCl2溶液中的FeCl3 ——(加入CuO,过滤) |
| D.除去KNO3中混有的NaCl——(溶解,蒸发,过滤) |