(10分)一定温度时,在容积一定的密闭容器中,反应A(s)+B(g) C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
(1)正反应是 (填“放热”或“吸热”)反应;该反应的化学平衡常数的表达式是 。
(2)能判断该反应一定达到平衡状态的依据是 。(填写字母编号)
A. 体积分数组成C%=D%
B. 单位时间内生成n moAl的同时生成n molC
C. 温度和体积一定是,某一生成物浓度不再变化
D. 温度和体积一定是,容器内压强不再变化
(3)该反应的正反应速率随时间变化的关系如右图所示。
T2时改变了某种条件,改变的条件是 。(填写字母编号)
A.升温 B.加压 C.催化剂 D.增加A的量
(4)升高温度到T℃时,在一密闭容器中充入2mol A和3mol B,发生上述反应。平衡后测得K=1。然后在温度不变的情况下,扩大容器容积至原来的10倍,结果A的百分含量始终未改变,则此时B的转化率是 。
下列提纯方法不正确的是
| A.除去KNO3中的NaCl杂质-----------结晶.重结晶 |
| B.除去食盐中的泥沙-----------过滤 |
| C.除去KCl中的K2CO3------------加适量盐酸 |
| D.除去碘水中的水-----------升华 |
(06年上海化学26)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如下图装置。倾斜A使稀硫酸(足量)与固体 M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为V mL(已折算成标准状况)由上述实验事实可知: 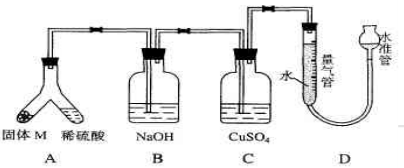
(1)①固体M中一定有的物质是_____(填化学式)理由是_____。②其中一种物质的质量可以确定为____g(用代数式表示)。
(2)B装置的名称是_____。写出B装置中反应的离子方程式_____。
(3)C装置的作用是_____,如果实验中没有B装置,则C装置中产生的现象是__________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是__________
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥
第四周期第六个元素的价电子构型是。
A、B、C三种短周期元素,原子序数依次增大,三种元素数依次之和为35,A、C同族,B+离子核外有10个电子,回答下列问题
①A、B、C三种元素分别是____ 、 ____ 、___ __。
②A、B、C之间形成多种化合物,其中属于离子化合物的化学式分别为______、____、___。
③分别写出A、B、C的电子排列式:
A_____;B____;C_____
下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
| 原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
| 最高价态 |
+1 |
+1 |
/ |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
/ |
| 最低价态 |
/ |
/ |
-2 |
/ |
-4 |
-3 |
-1 |
/ |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是(填编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)。
(3)某元素R的原子半径为1.02×10-10m,该元素最高价氧化物的水化物化学式为;若物质Na2R3是一种含有非极性共价键的离子化合物,请你尝试写出该化合物的电子式。