将一定量的SO2和含0.7mol O2的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2(g)+O2(g)  2SO3(g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(以下计算结果均保留一位小数)
2SO3(g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(以下计算结果均保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。
A.SO2和SO3的浓度相等
B.SO2的百分含量保持不变
C.容器中气体的压强不变
D.SO3的生成速率与SO2的消耗速率相等E.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。
A.向装置中再充入N2 B.向装置中再充入O2
C.改变反应的催化剂 D.升高体系温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示) 。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液中,则生成 克沉淀。
某有机物只含碳、氢、氧三种元素,其质量比为6:1:8。该有机物蒸气的密度是相同条件下乙烷的2倍,试求该有机物的相对分子质量及分子式。根据下列条件写出该有机物的同分异构体的结构简式:
①该有机物常温下能跟碳酸氢钠溶液反应;
②该有机物能产生银镜;
③该有机物既能产生银镜,又能与钠反应生成氢气
由A、B两种物质组成的混合气体,其平均相对分子质量随A的物质的量分数变化关系如右图所示。
求:A、B的相对分子质量,若测得混合气体中仅含两种元素,A、B都是有机物时,写出化学式。
在100mL 2.00mol/L的Ba(OH)2溶液中滴加100mL NaHSO4溶液,测得溶液的pH为1.00,求产生的沉淀的质量,以及NaHSO4溶液的物质的量浓度(设两种溶液混合时体积变化忽略不计)。
将2.56g金属铜投入到一定物质的量浓度的浓硝酸中,生成气体颜色越来越浅,当恰好完全反应时,共收集到标准状况下896mL气体。
(1)、写出可能发生反应的化学方程式
____________________________________________________________
_____________________________________________________________
(2)、计算参加反应的硝酸的物质的量是多少?
(3)将盛有生成气体的容器倒扣在水槽中,通入标准状况下一定体积的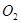 ,恰好使气体完全溶于水。则通入
,恰好使气体完全溶于水。则通入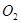 的体积为多少?(3分)
的体积为多少?(3分)
物质的量相同的NaHCO3和KHCO3固体混合物9.20g与100mL盐酸反应。
(1)欲求标准状况下生成CO2的体积,还需要什么数据__________________。(讨论(2)的问题中,该数据用a表示)
(2)讨论a值的变化时,产生CO2的体积(标准状况)
| a |
生成CO2的体积(L) |