实验室在1L密闭容器中进行模拟甲醇合成实验:CO(g)+2H2(g) CH3OH(g)。将lmolCO和2molH2通人容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol·L—1)
CH3OH(g)。将lmolCO和2molH2通人容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol·L—1)
| |
10min |
20min |
30min |
40min |
50min |
60min |
| 300℃ |
0.40 |
0.60 |
0.75 |
0.84 |
0.90 |
0.90 |
| 500℃ |
0.60 |
0.75 |
0.78 |
0.80 |
0.80 |
0.80 |
①300℃时反应开始10分钟内,H2的平均反应速率为__________。
②500℃时平衡常数K的数值为___________。
③300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是__________(填字母)。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时c(H2)/c(CH3OH)减小
下列实验装置图的实验操作,不能达到相应的实验目的是
某无色透明溶液可能含有K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等离子,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是(填代号)。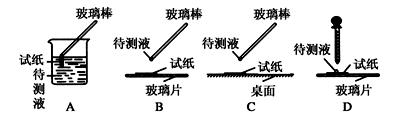
(2)根据上述实验判断原溶液中肯定存在的离子是,肯定不存在的离子是。
(3)写出实验③的离子方程式:。
(4)设计实验证明,通过上述实验仍无法确定的阳离子到底是否存在(简要说明操作过程、实验现象和结论)。
某白色粉末其成分可能是碳酸钠和亚硫酸钠的一种或两种组成。请完成对该白色粉末成分的探究(可供选用的实验仪器及试剂如下)。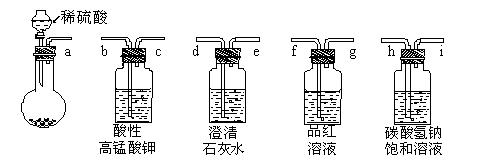
(1)提出合理假设
假设1:该白色粉末成分为碳酸钠;
假设2:该白色粉末成分为亚硫酸钠;
假设3: 。
(2)从上述仪器和试剂中选择合适的组合,一次性判断出该白色粉末的组成,其最佳连接顺序是:a—(每组选用仪器和试剂限用一次)。
(3)根据(2)的连接顺序进行实验,填写相应现象。
| 假设方案编号 |
相应现象 |
| 假设1 |
|
| 假设2 |
|
| 假设3 |
下图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题: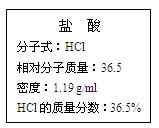
(1)该浓盐酸中HCl的物质的量浓度为。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_________(填编号)。
| A.溶液中HCl的物质的量 | B.溶液的浓度 |
| C.溶液中Cl—的数目 | D.溶液的密度 |
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.40 mol/L的稀盐酸。
①该学生需要量取mL(精确到小数点后一位)上述浓盐酸进行配制。
②现有a.10 mL量筒;b. 25 mL量筒;c.烧杯;d.托盘天平;e. 500 mL容量瓶;f.胶头滴管;g.玻璃棒,请从其中选取必要的仪器,按各仪器第一次使用先后顺序排序:(填编号)。
③在配制过程中,下列实验操作对所配制盐酸物质的量浓度有何影响?(在空格中填 “偏高”、“偏低”或“无影响”):
定容时俯视观察_________;
定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水__________。
某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现黑色和红色交替的现象,请写出相应的化学方程式
、。
(2)甲水浴的作用是;
乙水浴的作用是。
(3)反应进行一段时间后,干试管a中能收集到不同的物质,它们是。集气瓶中收集到的气体的主要成分是。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。要除去该物质,可在混合液中加入(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳