用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.1mol/L的溶液100mL;
②用PH试纸测出该溶液的PH值,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制PH=1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是_____________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的PH_________1(选填>、<、
=);
乙方案中,说明HA是弱电解质的现象是_____________(多选扣分)
(a)装HCl的试管中放出H2的速率快
(b)装HA溶液的试管的中放出H2的速率快
(c)两个试管中产生气体速率一样快
(3)请你评价:乙方案中难以实现之处和不妥之处________________________。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
据报道,2001年5月26日中午,广东湛江发生一起浓硫酸泄漏事件,防化兵采取的有效措施是:首先挖坑疏导浓硫酸液体,同时紧急调用10t烧碱与浓硫酸发生反应,其反应的化学方程式为。防化兵当时能否调用熟石灰来代替烧碱?
苏丹红是—类染色剂。在我们日常接触的物品中,家用的红色地板漆或红色鞋油通常含有苏丹红的成分。根据2004年4月MSDS提供的数据,苏丹红存在有限的致癌作用,不可服用。2005年2月23日中国政府发布紧急公告,禁止苏丹红作为食品添加剂。下表是苏丹红1号的有关信息:
| 编号 |
化学式 |
C16H12N2O |
| ① |
外观 |
暗红色或深黄色片状晶体 |
| ② |
溶解度 |
在水中:<0.01g/100mL;汽油中:任意比例互溶。 |
| ③ |
熔点 |
404~406℃ |
| ④ |
沸点 |
475℃ |
| ⑤ |
致癌原因 |
在人体内分解出一种有毒的有机物(苯胺) |
试回答下列问题:
(1)苏丹红l号中含有种元素,各元素原子的物质的量比为nC:nH∶nN∶nO=,其中氮元素的质量分数为(结果保留一位小数)。
(2)在上表给出的信息中,属于苏丹红1号物理性质的有(填编号)。
(3)苏丹红l号对动物和人体有致癌作用,主要是因为该物质在体内发生了(填“物理”或“化学”)变化。
2003年6月5日世界环境日的主题是:“水——二十亿人生命之所系”。节约用水,防治水污染具有十分重要的意义。某工厂有甲、乙、丙三个车间,各自排放的污水中均无沉淀物。各车间的污水分别含有以下六种物质中的各两种:KOH、K2SO4、AgNO3、Ba(NO3)2、KCl、HNO3。为防止污染水源,某中学化学兴趣小组配合工厂分别用石蕊试液和氯化钡溶液进行污水检测,现象如下:
甲:蓝色(石蕊试液)、白色沉淀(氯化钡溶液);乙:紫色(石蕊试液)、无明显现象(氯化钡溶液);丙:红色(石蕊试液)、白色沉淀(氯化钡溶液)。
由此可确定丙车间排放的污水中含有和。为变害为利,化学兴趣小组与工厂研究设计如下图污水处理方案。请回答:沉淀A是,若各步处理均完全反应,最终排放液C的溶质是,在农业上它可用作复合肥料。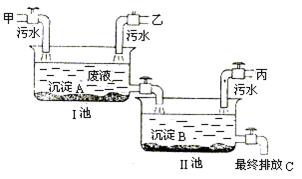
下列物质中属于强电解质的是_____________,属于弱电解质的是________。
| A.H2O | B.CH3COOH | C.NaHCO3 |
| D.BaSO4E.H2SO3F.H2SO4 |
下列物质属于电解质的是____________________(填编号)。
①Zn ②NaCl(s) ③Na(s) ④酒精 ⑤H2SO4(l) ⑥NH3 ⑦SO2 ⑧NaOH(s) ⑨C(石墨固体) ⑩Na2O