下列离子方程式,错误的是
| A.钠投入水中:Na+H2O══ Na++OH-+H2↑ |
| B.碳酸钙与盐酸反应:CaCO3+2H+══ Ca2++CO2↑+H2O |
| C.钠投入硫酸铜溶液中:2Na+Cu2+══ Cu+2Na+ |
| D.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++HCO3-+OH-══ CaCO3↓+H2O |
下列图象能正确地表达可逆反应3A(g)+B(g)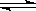 2C(g)(△H<0)的是
2C(g)(△H<0)的是
关于下列各装置图的叙述不正确的是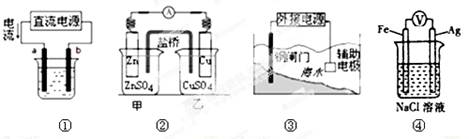
| A.用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 |
| B.图②装置的盐桥中KCl的Cl—移向甲烧杯 |
| C.图③装置中钢闸门应与外接电源的负极相连获得保护 |
| D.装置④中Ag电极发生反应:2H2O + 2e-= H2↑+ 2OH- |
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是
| A.△H2>△H3 | B.△H1<△H3 |
| C.△H1+△H3 =△H2 | D.△H1+△H2>△H3 |
某反应2AB(g) C(g)+3D(g)在高温下能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
C(g)+3D(g)在高温下能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
| A.ΔH<0,ΔS>0 | B.ΔH <0,ΔS<0 |
| C.ΔH>0,ΔS>0 | D.ΔH>0,ΔS<0 |
下列说法中,正确的是
| A.强电解质溶液一定比弱电解质溶液的导电性强 |
| B.强电解质的水溶液中不存在分子 |
| C.SO2和乙醇均属共价化合物,在水中都不能电离,均属非电解质 |
| D.不同的弱电解质只要物质的量浓度相同,电离程度也相同 |